Щелочной раствор - реагент
Cтраница 1
Щелочной раствор реагента остается длительное время прозрачным. Избыток щелочи способствует растворению осадка NaH bC и понижает чувствительность реакции. [1]
Мет щелочным раствором комплексоо бразую-щего реагента 1при температуре 85 - 95 С с последующим пассивирова - П ием металла раствором гидразина и аммиака. [2]
Метод основан на способности сульфид-ионов гасить зеленую люминесценцию щелочного раствора реагента. Чувствительность реакции 0 01 мкг сульфид-иона в 10 мл 1 % - ного раствора КОН. Измерение интенсивности люминесценции производят при 530 ммк. [3]
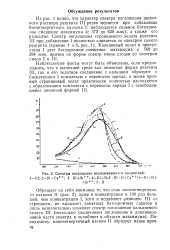 |
Спектры поглощения исследовавшихгя соединений. / Ш. 2 - Ш Са. 3 IIl Sr. 4 - ll ll. 5 - III U - - Ca 6 - l f II. [4] |
Из рис. 1 видно, что характер спектра поглощения щелочного раствора реагента III резко меняется при добавлении бисчетвертичного катиона I: наблюдается сильное батохром-ное смещение максимума ( с 572 до 620 ммк), а также его размытие. [5]
Применяют спиртовый раствор реагента, который устойчив продолжительное время; щелочные растворы реагента менее устойчивы. [6]
К 2 - 3 каплям соли магния прибавляют 1 каплю щелочного раствора реагента. Если раствор кислый, то появляется желтая окраска. При добавлении нескольких капель щелочи образуется синий осадок. В присутствии малых количеств соли магния раствор окрашивается в синий цвет. [7]
В кислых растворах при комнатной температуре молибден ( У1) реагирует медленно со щелочным раствором реагента, который в этих условиях осаждается. Реакцию ускоряют небольшие количества железа, присутствующего в виде Fea в восстановительной среде, и высокая температура. В отсутствие железа равновесие достигается при 75 за 15 - 20 мин. [8]
Для выполнения реакции к 1 капле раствора соли магния прибавляют 1 - 2 капли щелочного раствора реагента. В зависимости от количества Mg24 либо образуется синий осадок, либо красно-фиолетовый цвет раствора переходит в синий. Появление желтой окраски раствора указывает на то, что исследуемый раствор имеет слишком кислую реакцию. В таком случае нужно добавить к нему несколько капель раствора щелочи. Ионы Са2, Sr2i и Ва2, а также А13 и Мп2 - - реакции не мешают. Если присутствуют большие количества солей аммония, их следует удалить. [9]
Для определения содержания редуцирующих Сахаров, при титровании которых наилучшим реагентом являются соли меди, применяют щелочные растворы реагента, в которых ионы меди находятся в растворе в комплексном состоянии. [10]
Щелочные растворы реагента флуоресцируют в УФ-свете ярким зеленым цветом. В присутствии сульфидной серы, а также тиофенола, метилмеркаптана, тиомочевины, тиоацетамида, диэтилдитиокар-баматов и других серусодержащих веществ флуоресценция раствора гасится вследствие взаимодействия реактива с серусодержа-щим остатком. При титровании раствором тетрартутьацетатфлуоресцеина растворов серусодержащих веществ в ультрафиолетовом свете в точке эквивалентности возникает яркая зеленая флуоресценция. Чувствительность реакции при измерении флуоресценции в области 530 нм составляет 0 01 мкг серы в 10 мл 1 % - ного раствора КОН. [11]
В щелочной среде и в присутствии 10 % - ного цианида калия и 40 % - ного раствора формальдегида ионы кадмия дают коричневый осадок со спиртовым раствором динитро-дифенилкарбазида, который при отстаивании меняет окраску до зеленовато-синей. Щелочной раствор реагента, имеющий красную окраску, изменяет ее до фиолетовой из-за присутствия формальдегида, поэтому при незначительных количествах кадмия необходимо сравнение с холостой пробой. [12]
Бесцветные ( желтоватые листочки, иглы; / Пл 179 5 - 180 С, растворим в эт. Наиболее устойчивы щелочные растворы реагента. Очищают перекристаллизацией из эт. [13]
 |
Технологическая схема установки очистки газов от сероводорода по мышьяково-содовому процессу. [14] |
Немаловажной характеристикой процесса является степень развития побочных реакций. В условиях применения щелочных растворов реагентов не весь поглощенный сероводород превращается в серу. Часть его вступает в побочную реакцию с образованием тиосульфатов, в связи с чем из цикла он должен выводиться вместе с частью поглотительного раствора. По практическим данным, около 10 - 20 % серы, поглощенной из газа мышьяково-содовым раствором, окисляется при регенерации раствора в гипосульфит. В железо-щелочных процессах в гипосульфит превращается до 30 - 40 % от веса поглощенной серы. Попутно отметим, что попытки модифицировать железо-щелочные процессы путем замены железа никелем или медью не нашли применения в промышленности. [15]
Страницы: 1 2