Твердый раствор - кислород
Cтраница 1
 |
Трещины в вюститной фазе окалины у армко-железа, образовавшиеся после 5-мин нагрева при 1090 С ( травление 20 % НС1. Х260. [1] |
Твердый раствор кислорода в железе обладает иными свойствами, чем железо, что сказывается на его повышенной стойкости против коррозии и хорошо выявляется при травлении, а также на его электрохимическом потенциале. [2]
Очень интересны твердые растворы кислорода. Экспериментально установлено, что различные производные закиси железа - фосфаты, арсенаты, силикаты постепенно окисляются кислородом, окрашиваясь в различные цвета - синий, зеленый, бурый до черного. При этом более половины всей закиси железа может быть переведено в окись, при сохранении видимой однородности вещества. Параллельно с возрастанием содержания окиси железа уменьшается содержание воды. Соответствующая изотерма упругости пара [240] имеет вид непрерывной кривой, свойственной гидратным веществам цеолитного типа. [3]
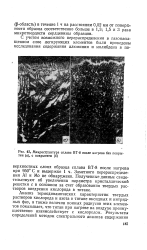 |
Микроструктура сплава ВТ-8 после нагрева без покрытия ( а, с покрытием ( б. [4] |
Анализ термодинамических характеристик твердых растворов кислорода и азота в титане оксидных и нитрид-ных фаз, а также величин ионных радиусов этих элементов показывает, что титан при нагреве на воздухе преимущественно взаимодействует с кислородом. [5]
Как только состав твердого раствора кислорода в титане достигнет состава ТЮо2, он растрескивается, по-видимому, благодаря различиям в температурных коэффициентах и удельных объемах основного металла и твердого раствора. Благодаря растрескиванию на поверхности титана образуется слой тонкодисперсных частиц состава ТЮо2, часть из которых диффундирует в расплав, где окисляется до рутила. Вследствие растрескивания на поверхности корродирующего металла не возникает защитного слоя продуктов окисления. Этим объясняется линейный характер закона окисления ( см. фиг. [6]
 |
Схема образования твердых растворов различных типов. [7] |
Так, в твердом растворе кислорода в закиси железа ( вюстит) все узлы решетки, в которых должны находиться ионы кислорода, заполнены, часть же узлов, в которых должны располагаться ионы железа, свободны. На рис. 60 показана схема образования твердых растворов различных типов. [8]
Продуктами окисления могут быть твердые растворы кислорода в металле и их химические соединения. Если окисление продолжается выше предела насыщения, то из раствора выпадают окислы. Известно, что железо с кислородом образуют три вида окислов. Они представляют собой различные фазы в системе O2 - Fe с различным типом кристаллической решетки: вюстит FeO, магнетит Fe. Вюстит растворим в железе и устойчив при температуре выше 57 () С; ниже атой температуры он распадается на магнетит и чистое железо: 4FeO Ре О4 Fe. Магнетит и гематит устойчивы во всем диапазоне температур от комнатной до температуры плавления. [9]
Продуктами окисления могут быть твердые растворы кислорода в металле и их химические соединения. Если окисление продолжается выше предела насыщения, то из раствора выпадают окислы. Вюстит растворим в железе и устойчив при температурах выше 570 С; ниже этой температуры он распадается на магнетит и чистое железо 4FeO - Fe3O4 Fe. Магнетит и гематит устойчивы во всем диапазоне температур до точек плавления. Пленка на железе состоит из слоев, расположенных от поверхности внутрь В последо-вательности, соответствующей убыванию кислорода в окисле. При температуре ниже 570 С пленка может состоять из одного слоя Fe3O4, из наружного слоя Fe2O3 и следующего за ним Слоя Fe3O4 или из слоев Fe2O3, Fe3O4 и FeO, причем распад FeO идет вслед за его образованием. [10]
Продуктами окисления могут быть твердые растворы кислорода в металле и их химические соединения. Если окисление продолжается выше предела насыщения, то из раствора выпадают окислы. Известно, что железо с кислородом образуют три вида окислов. Они представляют собой различные фазы в системе О2 - Fe с различным типом кристаллической решетки: вюстит FeO, магнетит Fe3O4 и гематит Ре2Оз - Вюстит растворим в железе и устойчив при температуре выше 570 С; ниже этой температуры он распадается на магнетит и чистое железо: 4FeO FejO4 Fe. Магнетит и гематит устойчивы во всем диапазоне температур от комнатной до температуры плавления. [11]
При взаимодействии SiO2 с титаном образуется твердый раствор кислорода в титане и появляются интерметаллические соединения титана с кремнием, так как последний не дает твердых растворов с титаном. [12]
При взаимодействии SiO2 с титаном образуется твердый раствор кислорода в титане и появляются интерметаллические соединения титана с кремнием, так как последний не дает твердых растворов с титаном. [13]
Это дало возможность установить границу однородности твердых растворов кислорода в а-титане; она соответствует приблизительно составу ТЮ0 18 ( 14 4 вес. [14]
В системе Та-О установлено две фазы: твердый раствор кислорода в тантале и Ta Os. [15]
Страницы: 1 2 3 4