Концентрированный раствор - серная кислота
Cтраница 2
При этом в концентрированных растворах серной кислоты галоидные иоиы, адсорбируясь на поверхности некоторых сталей, сами могут приводить к пассивации. Такой эффект может быть объяснен следующим. При адсорбции галоидов точка нулевого заряда железа смещается в сторону положительных потенциалов; одновременно с этим потенциал саморастворения железа в серной кислоте становится более электроотрицательным. В таком случае из-за изменения t 5i-потенциал а процесс ионизации железа затрудняется. [16]
Например, в концентрированных растворах серной кислоты арилгидроксиламины вступают в реакцию Гаттермана с образованием соответствующих аминофенолов. [17]
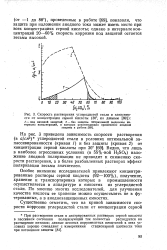 |
Скорость растворения углеродистой стали в зависимости от концентрации серной кислоты ( 30, ио данным. [18] |
Особое внимание исследователей привлекают концентрированные растворы серной кислоты ( 92 - 100 %), получение, хранение и транспортировка которых в промышленности осуществляется в аппаратуре и емкостях из углеродистой стали. [19]
Последнюю получают при электролизе концентрированных растворов серной кислоты или гидросульфатов. [20]
Осадок труднорастворим даже в довольно концентрированных растворах серной кислоты. После прокаливания при температуре 1000 С гидрофосфаты циркония переходят в пирофос-фат ZrP207, нерастворимый во всех разбавленных кислотах, кроме фтористоводородной. Пирофосфат циркония используется для гравиметрического определения содержания циркония. Фосфат гафния еще менее растворим в кислотах, чем соответствующая соль циркония, что используется для фракционного разделения этих элементов. [21]
Смешивают в пробирке 1 мл концентрированного раствора серной кислоты и 1 мл изопропилового спирта. Смесь осторожно нагревают до кипения. [22]
Сернокислотные резервуары предназначены для хранения концентрированных растворов серной кислоты ( 75 и 93 8 %), разбавленной серной кислоты и олеума. Резервуары работают как в статическом, так и в циклическом режимах нагружения. [23]
Для защиты оборудования от воздействия концентрированных растворов серной кислоты толщина свинцового покрытия составляет 200 - 1000 мк, а в специальных случаях - может достигать нескольких миллиметров. В последнее время для некоторых гальванических процессов ( хромирование, электрополирование) успешно применяются алюминиевые аноды, покрытые тонким слоем свинца. [24]
Равновесное давление насыщенного пара над концентрированными растворами серной кислоты существенно ниже, чем над ди - и полугидратом сульфата кальция, в результате чего эти растворы способны отнимать влагу у соответствующих кристаллогидратов. Так, например, при температуре 70 С давление насыщенного пара над 95 % - ной серной кислотой составляет 0 28 мм рт. ст., давление паров воды над ди-гидратом сульфата кальция 26 мм рт. ст.; при температуре 120 С - над 95 % - ной серной кислотой 0 8 мм рт. ст., а над полугидратом сульфата кальция 41 мм рт. ст. Существование при 120 С нерастворимого ангидрита при дегидратации подкисленного образца также можно объяснить исходя из образования высококонцентрированного поверхностного раствора серной кислоты, который отнимает остаточную воду и, таким образом, способствует образованию нерастворимого ангидрита. [25]
Так, ион никеля в концентрированных растворах серной кислоты дает желтое окрашивание, а ион меди ( II) - зеленое, но едва ли потому, что здесь имеются полностью несольватированные ионы металла, а скорее благодаря присутствию соответствующих комплексов серной кислоты, ( ср. [26]
Падение выхода по току в концентрированных растворах серной кислоты объясняется возрастанием скорости гидролиза пероксодвусерной кислоты. Практически в производстве пероксодвусерной кислоты используют растворы, содержащие 550 - 625 г / л H2SO4, так как более концентрированная серная кислота обладает слишком малой удельной электропроводностью. [27]
Падение выхода по току в концентрированных растворах серной кислоты объясняется возрастанием скорости гидролиза пероксодвусерной кислоты. Практически в производстве пероксодвусерной кислоты используют растворы, содержащие 550 - 25 г / л H2SO4, так как более концентрированная серная кислота обладает слишком малой удельной электропроводностью. [28]
Так, ион никеля в концентрированных растворах серной кислоты дает желтое окрашивание, а ион меди ( II) - зеленое, но едва ли потому, что здесь имеются полностью несольватированные ионы металла, а скорее благодаря присутствию соответствующих комплексов серной кислоты. [29]
Описан метод, при котором из концентрированных растворов серной кислоты выделяют органические примеси с применением диффузионного обмена на ионообменных мембранах ( пат. Независимо от концентрации органических примесей и серной кислоты обеспечивается значительная скорость диализа. [30]
Страницы: 1 2 3 4