Концентрированный раствор - серная кислота
Cтраница 3
Получение пероксодвусерной кислоты следует осуществлять в концентрированных растворах серной кислоты. [31]
В каждую колбу прибавим по 1 мл концентрированного раствора серной кислоты ( среда) и затем восстановитель: по 5 мл 5 % - ного раствора KI. Во всех трех колбах выделяется иод. [32]
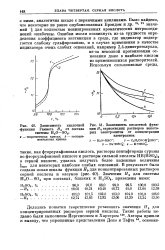 |
Зависимость кислотной функции Гаммета Я0 от состава.| Зависимость кислотной функции Я в сернокислых растворов некоторых электролитов от концентрации электролита. [33] |
Делались попытки теоретически установить значения Н0 для концентрированных растворов серной кислоты. [34]
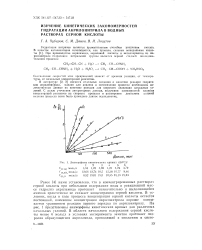 |
Анаморфозы кинетических кривых ( 50СС. [35] |
Ранее [4] нами установлено, что в концентрированных растворах серной кислоты при небольшом содержании воды в реакционной массе гидролиз акриламида протекает незначительно и выделяющийся аммиак практически не снижает концентрацию серной кислоты. В условиях, когда в ходе процесса концентрация серной кислоты остается постоянной, изменение концентрации акрилонитрила хороша описывается уравнением реакции первого порядка по акрилонитрилу. На рис. 1 представлены анаморфозы кинетических кривых для различных начальных условий. [36]
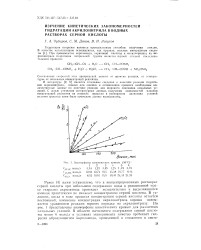 |
Анаморфозы кинетических кривых ( 50С. [37] |
Ранее [4] нами установлено, что в концентрированных растворах серной кислоты при небольшом содержании воды в реакционной массе гидролиз акриламида протекает незначительно и выделяющийся аммиак практически не снижает концентрацию серной кислоты. В условиях, когда в ходе процесса концентрация серной кислоты остается постоянной, изменение концентрации акрилонитрила хорошо описывается уравнением реакции первого порядка по акрилонитрилу. На рис. 1 представлены анаморфозы кинетических кривых для различных начальных условий. [38]
Кинетика и механизм образования Ог Н28208и 03 при электролизе концентрированных растворов серной кислоты на платиновых электродах определяются состоянием поверхности анода, природой промежуточных соединений, образующихся на поверхности анода при разряде, и адсорбцией на электроде этих соединений или других кодшопентов применяемого электролита. При потенциалах ниже 2 1 В кинетика выделения кислорода при электролизе крепкой серной кислоты определяется свойствами высшего кислородного окисла на поверхности анода из металла платиновой группы. [39]
Кинетика и механизм образования 02 Н28208и 03 при электролизе концентрированных растворов серной кислоты на платиновых электродах определяются состоянием поверхности анода, природой промежуточных соединений, образующихся на поверхности анода при разряде, и адсорбцией на электроде этих соединений или других кодшопентов применяемого электролита. При потенциалах ниже 2 1 В кинетика выделения кислорода при электролизе крепкой серной кислоты определяется свойствами высшего кислородного окисла на поверхности анода из металла платиновой группы. [40]
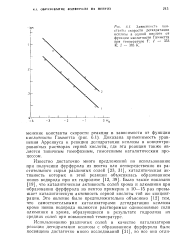 |
Зависимость константы скорости дегидратации ксилозы в серной кислоте от функции кислотности Гамметта при температуре Т. 1 - 353 К. 2 - 383 К. [41] |
Доказана применимость уравнения Аррениуса к реакции дегидратации ксилозы в концентрированных растворах серной кислоты, где эта реакция также является типичным гомофазным, гомогенным каталитическим процессом. [42]
 |
Кривые анодной поляризации стали в фосфорнокислом и фосфорно-хромовокислом электролитах. Состав электролитов ( %. [43] |
Эти исследования показали, что анодная обработка алюминия в концентрированных растворах серной кислоты приводит к полированию. [44]
Метод основан на взаимодействии борной кислоты с ацетилхинализарином в концентрированных растворах серной кислоты с образованием голубого комплекса. Замена хинализарина ацетилхинализарином значительно увеличивает чувствительность и контрастность реакции. Метод позволяет определять от 7 5 - 10 - 4 до 5 % В в цирконии и в сплавах циркония с ниобием. Продолжительность определения составляет 1 5 часа. Цирконий в форме фторидного комплекса не мешает определению бора. [45]
Страницы: 1 2 3 4