Разбавленный раствор - сильная кислота
Cтраница 3
В разбавленном растворе сильной кислоты висмут образует с тиомочевиной комплекс желтого цвета. Большое значение имеет концентрация реактива. [31]
Нитроцеллюлоза более устойчива к действию разбавленных растворов кислот, чем целлюлоза. При длительном воздействии разбавленных растворов сильных кислот на нитроцеллюлозу при высокой температуре содержание азота в ней не изменяется. Такого рода обработка широко применяется для очистки нитроцеллюлозы от ризкомолекулярных примесей. При нагревании кислые растворы разрушают находящиеся в нитроцеллюлозе низкомолекулярные, частично нитрованные сахаристые вещества, частично сульфированные нитроэфиры и др. Концентрированные минеральные кислоты разрушают нитроцеллюлозу. Так, например, концентрированная азотная кислота на холоду медленно, а при нагревании быстро денитрует и деструктирует нитроцеллюлозу, превращая ее в растворимые в кислоте и воде соединения; при этом выделяются газообразные продукты. На этой реакции основана методика определения содержания золы в нитроцеллюлозе. [32]
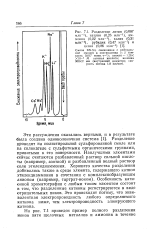 |
Разделение лития ( 0 087 млн -, натрия ( 0 26 млн-1, аммония ( 0 22 млн-1, калия ( 0 31 млн -, рубидия ( 0 47 млн-1 и. [33] |
Разделение проводят на полистирольной сульфированной смоле или на силикагеле с сульфатными органическими группами, привитыми к его поверхности. Наилучшими элюентами сейчас считаются разбавленный раствор сильной кислоты ( например, азотной) и разбавленный водный раствор соли этилендиаммония. Особенность кати-онной хроматографии с любым таким элюентом состоит в том, что разделенные катионы регистрируются в виде отрицательных пиков. Это происходит потому, что эквивалентная электропроводность любого определяемого катиона ниже, чем электропроводность элюирующего катиона. [34]
Хиназолоны неизменно представляют собой высокоплавкие кристаллические соединения, не растворимые в воде и большинстве органических растворителей, но растворимые в водных щелочах. Обычно они нерастворимы в разбавленных растворах сильных кислот, но иногда растворяются в концентрированных сильных кислотах. Бензоиленмо-чевииа в концентрированных минеральных кислотах не растворяется. [35]
Куп-феррон осаждает ванадий ( V) из разбавленного раствора сильной кислоты. [36]
Иначе обстоит дело в разбавленных растворах. Экспериментальные определения показывают, что теплота нейтрализации разбавленных растворов сильных кислот и сильных оснований имеет одну и ту же величину, в среднем равную 13 6 ккал, независимо от рода кислоты и основания. [37]
Купеферрон осаждает ванадий ( V) из разбавленного раствора сильной кислоты. [38]
Иначе обстоит дело в разбавленных растворах. Экспериментальные определения показывают, что теплота нейтрализации разбавленных растворов сильных кислот и сильных оснований имеет одну и ту же величину, в среднем равную 13 6 ккал, независимо от рода кислоты и основания. [39]
Такого рода расчеты находят интересное приложение при рассмотрении реакций нейтрализации кислот щелочами. Опытным путем установлено, что теплота нейтрализации разбавленного раствора любой сильной кислоты [ НС1, HBr, HI, HN03, H2S04 ( первый водород), HC10J и любого сильного основания ШаОН, КОН, Ва ( ОН) 2 ] равна 13 71 ккал на 1 эквивалент. [40]
Как видно из уравнения, концентрация ионов водорода при постоянной температуре ( константа диссоциации / С меняется с температурой) зависит не от абсолютных значений концентрации кислоты и соли, а от их отношения. Вследствие этого при разбавлении буферного раствора рН не меняется даже в том случае, если был взят разбавленный раствор сильной кислоты с буферной смесью. [41]
В связи с этим невозможно определить и точное значение раН стандартного раствора конечной концентрации на основании термодинамических данных, не прибегая к каким-либо допущениям при вычислении коэффициентов активности ионов водорода. Избавиться от погрешности при определении раН стандарта можно лишь в том случае, если в качестве стандартного выбран настолько разбавленный раствор сильной кислоты, что в нем коэффициенты активности равны единице. Но такой раствор не обладает всеми свойствами стандарта, так как он имеет ничтожную буферную емкость. [42]
В связи с этим невозможно определить и точное значение раН стандартного раствора конечной концентрации на основании термодинамических данных, не прибегая к каким-либо допущениям при вычислении коэффициентов активности ионов водорода. Избавиться от погрешности при определении р0Н стандарта можно лишь в том случае, если в качестве стандартного выбран настолько разбавленный раствор сильной кислоты, что в нем коэффициенты активности равны единице. Но такой раствор не обладает всеми свойствами стандарта, так как он имеет ничтожную буферную емкость - Кроме того, при измерении рН с помощью такого раствора ошибки за счет диффузионных потенциалов будут тем больше, чем меньше концентрация стаадарта. [43]
Страницы: 1 2 3