Разбавленный раствор - соль
Cтраница 2
Для разбавленных растворов солей ионов одинакового заряда отношение 7А / ув близко к единице и может быть легко определено. Если ионы А и В имеют разные заряды, то отношение иное; для обмена однозарядного иона на двухзарядный отношение ТА / ТВ равно 0 5 при ионной силе раствора от 0 5 до 1 и им нельзя пренебрегать. [16]
К нейтральному разбавленному раствору соли калия добавляют немного 0 02 N раствора AgNO3 и избыток концентрированного раствора нитрокобальтиата натрия; при этом выпадает желтый осадок нитрокобальтиата калия и серебра. В отсутствие калия осадок не образуется. В исследуемом растворе должны отсутствовать хлориды и другие анионы, осаждаемые нитратом серебра. [17]
С разбавленными растворами солей серебра п-диметиламино-бензилиденродамин не образует осадка, а только окрашивает раствор в интенсивно фиолетовый цвет. [18]
В разбавленных растворах солей и катион, и анион гидратированы большим числом молекул воды, что по предыдущему ведет к ослаблению деформации каждой из них. Индивидуальные различия поляризующего действия ионов оказываются поэтому более или менее сглаженными. [19]
В разбавленных растворах солей и катион и анион гидратированы большим числом молекул воды, что ведет к ослаблению деформации каждой из них. Индивидуальные различия поляризующего действия ионов оказываются поэтому более или менее сглаженными. [20]
 |
Кристаллы [ IMAGE ] Кристаллы. [21] |
В разбавленных растворах солей Са осадок получается медленно к имеет иную форму кристаллов. [22]
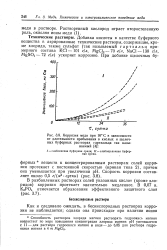 |
Коррозия меди при 16 С в зависимости от длительности пребывания в кислых и щелочных буферных растворах гартзальца так называемый. [23] |
В разбавленных растворах солей указанных кислот ( кроме хлоридов) коррозия протекает значительно медленнее. [24]
Температуру кипения разбавленных растворов солей можно определить приближенно, принимая, что разность между температурами кипения разбавленного раствора и воды остается при любом разрежении такой же, как и при атмосферном дав лени и, причем растворы кипят при более высокой температуре, чем чистая вода. [25]
 |
Кристаллы КС1О4 или [ IMAGE ] Кристаллы RbMnO4. [26] |
В случае разбавленных растворов солей К осадок появляется спустя несколько минут, когда некоторая часть капли успеет испариться. [27]
К капле разбавленного раствора соли NH4 в пробирке или на капельной пластинке прибавляют 2 капли реагента Несслера. Наблюдают появление желто-оранжевого окрашивания или красно-бурого осадка. [28]
Температуру кипения разбавленных растворов солей можно приближенно определить, принимая, что разность температур кипения разбавленного раствора и воды остается при любом разрежении такой же, как и при атмосферном давлении, причем растворы кипят при более высокой температуре, чем чистая вода. [29]
Температуру кипения разбавленных растворов солей можно определить приближенно, принимая, что разность между температурами кипения разбавленного раствора и воды остается при любом разрежении такой же, как и при атмосферном давлении, причем растворы кипят при более высокой температуре, чем чистая вода. [30]
Страницы: 1 2 3 4