Разбавленный раствор - хлорид - натрий
Cтраница 1
 |
Схема ионного. [1] |
Разбавленный раствор хлорида натрия вводят в верхнюю часть колонки. [2]
По поляризационным кривым, снятым в разбавленных растворах хлорида натрия ( концентрация йаС1 - от 10 до 50 г / л), хлорид-хлорат-ных растворах соостаточной концентрацией хлорида 20 - 50 г / л, т.е. в условиях электросинтеза, где большая доля тока идет на процесс выделения кислорода, выбраны величины потенциала анода для проведения электросинтеза в потенциостатических условиях. [3]
При комнатной температуре в воде или разбавленном растворе хлорида натрия выход по току цинка, выступающего в качестве анода, постепенно уменьшается вследствие образования на его поверхности изолирующих продуктов коррозии. Эта тенденция менее выражена на цинке высокой листоты, на котором в меньшей степени образуются изолирую-1 щие пленки. [4]
По поляризационным кривым, снятым в разбавленных растворах хлорида натрия ( концентрация № аС1 - от 10 до 50 г / л), хлорид-хлорат-ных растворах соостаточной концентрацией хлорида 20 - 50 г / л, т.е. в условиях электросинтеза, где большая доля тока идет на процесс выделения кислорода, выбраны величины потенциала анода для проведения электросинтеза в потенодостатических условиях. [5]
По поляризационным кривым, снятым в разбавленных растворах хлорида натрия ( концентрация fed - от 10 до 50 г / л), хлорид-хлорат-ных растворах соостаточиой концентрацией хлорида 20 - 50 г / л, т.е. в условиях электросинтеза, где большая доля тока идет на процесс выделения кислорода, выбраны величины потенциала анода для проведения электросинтеза в потенциостатических условиях. [6]
По поляризационным кривым, снятым в разбавленных растворах хлорида натрия ( концентрация fed - от 10 до 50 г / л), хлорид-хлорат-ных растворах соостаточной концентрацией хлорида 20 - 50 г / л, т.е. в условиях электросинтеза, где большая доля тока идет на процесс выделения кислорода, выбраны величины потенциала анода для проведения электросинтеза в потенциостатических условиях. [7]
По поляризационным кривым, снятым в разбавленных растворах хлорида натрия ( концентрация JfeCI-от 10 до 50 г / л), хлорвд-хлорат-ных растворах соостаточной концентрацией хлорида 20 - 50 г / л, т.е. в условиях электросинтеза, где большая доля тока идет на процесс выделения кислорода, выбраны величины потенциала анода для проведения электросинтеза в потенциостатических условиях. [8]
 |
Схема установки для анодирования серебряного электрода. [9] |
После приготовления электрод промывают дистиллированной водой и хранят в разбавленном растворе хлорида натрия, защищая от действия света. [10]
Опустим в U-образную стеклянную трубку две пластинки: железную и медную ( или угольную) согласно схеме рисунка 22, а. Нальем в трубку разбавленный раствор хлорида натрия NaCl и соединим обе пластинки проводом через вольтметр. В другое колено трубки добавим фенолфталеин. [11]
Одним из свойств жидкой воды, которое в первую очередь зависит от структуры, является вязкость или текучесть. Если сравнить чистую воду и разбавленный раствор хлорида натрия, то оказывается, что вязкость последнего больше и увеличивается с ростом концентрации растворенного вещества. Раствор хлорида лития в воде приблизительно иа 50 % более вязкий, чем раствор хлорида натрия той же концентрации. Однако раствор хлорида калия обладает несколько большей текучестью, чем чистая вода, а растворы хлоридов рубидия или цезия еще менее вязки, чем раствор хлорида калия. [12]
Простая модель, описывающая подвижность тРНК на таких колонках с обращенной фазой, сводится к равновесному анионному обмену. Когда тРНК наносят на колонку в разбавленном растворе хлорида натрия, ионы СГ -, связанные с четвертичными аммониевыми группами, обмениваются на фосфатные группы нуклеиновой кислоты. За счет электростатических взаимодействий тРНК удерживаются на колонке и их подвижность становится близкой к нулю. При более высоких концентрациях хлорида натрия в соответствии с законом действия масс ионы С1 - связываются с четвертичными аммониевыми группами, транспортные РНК высвобождаются в подвижную фазу и элюируют-ся с колонки. [13]
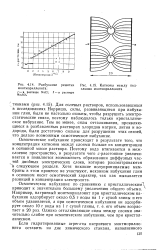 |
Разбухание решетки [ IMAGE ] Катионы между под-монтмориллонита. слоями монтмориллонита / - в растворе N301. 2 - в растворе. [14] |
Для солевых растворов, использовавшихся в исследованиях Норриша, силы, развивающиеся при набухании глин, были не настолько сильны, чтобы разрушить электростатические связи, поэтому наблюдалось только кристаллическое набухание. Тем не менее, силы отталкивания, проявляющиеся в разбавленных растворах хлоридов натрия, лития и водорода, были достаточно сильны для разрушения этих связей, что делало возможным осмотическое набухание. [15]
Страницы: 1 2