Разбавленный раствор - сильный электролит
Cтраница 1
Разбавленный раствор сильного электролита содержит растворенное вещество почти исключительно в виде ионов. В растворах слабых электролитов и в концентрированных растворах сильных электролитов имеются значительные количества недиссоциированных молекул. Если смешать раствор двух электролитов, то, находясь в непрерывном беспорядочном движении, ионы могут сталкиваться в различных комбинациях. Поэтому в водных растворах электролитов реакции идут не между молекулами, а между ионами. [1]
Для разбавленных растворов сильных электролитов теоретически вычисленные значения удовлетворительно совпадают с найденными опытным путем, что является большим успехом теории. [2]
В разбавленных растворах сильных электролитов величина растет практически линейно с концентрацией электролита. Это связано с увеличением общего числа ионов, в этом диапазоне концентраций скорость движения ионов не зависит от их концентрации. [3]
В разбавленных растворах сильных электролитов из ионов в небольшой степени могут образоваться также свободные комплексы, незаряженные или с незначительным зарядом. В растворах истинных электролитов это ионные пары, удерживаемые в основном электростатическим притяжением, тогда как в растворах потенциальных электролитов - ионные пары и ковалентные молекулы или только последние. Образование ионных пар или ковалентных молекул сопровождается сокращением числа носителей заряда и закон действующих масс справедлив для обоих процессов. Поэтому они одинаково влияют на зависимость проводимости от концентрации электролита. Следовательно, по измерениям зависимости проводимости от концентрации невозможно определить, каким явлением-образованием ковалентных молекул или ионных пар - обусловлено снижение в электролите числа возможных носителей заряда. Трудно ответить на этот вопрос и при помощи методов, основанных на других свойствах растворов ( например, осмотических и ( потенцио-метрических параметрах), которые также зависят от общего электростатического взаимодействия ионов. Однако в ряде случаев два типа ионной ассоциации можно различить путем измерения оптических параметров, поскольку ковалентные свя-зи заметно изменяют оптические свойства растворов. [4]
В разбавленных растворах сильных электролитов статистическое распределение, описываемое теорией Дебая - Хюккеля, развивается в общем как следствие электростатического взаимодействия ионов ( см. разд. Может, однако, оказаться, что ионы сближаются на расстояния, меньшие, чем-расстояния, соответствующие среднему распределению, и энергия их взаимного притяжения становится больше, чем средняя энергия теплового движения 3 / zkT на ион или 3feRT на моль. Несмотря на то что образование таких ионных пар является временным ( так как флуктуации энергии раньше или позже их разрушают), их разрушение, однако, происходит после нескольких столкновений с другими молекулами. Таким образом, такие ионные пары временно ведут себя как кинетические единицы. [5]
В разбавленном растворе сильного электролита ионы почти совершенно обособлены. Расстояния между ними относительно велики, а силы взаимодействия ослаблены. Это соответствует полной диссоциации. По мере увеличения концентрации электролита расстояния между ионами уменьшаются, а электростатическое взаимодействие усиливается. Создается определенная упорядоченность в расположении ионов. Все это создает видимость неполной диссоциация сильного электролита. [6]
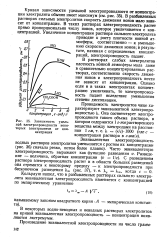 |
Зависимость удельной электропроводности некоторых электролитов от концентрации. [7] |
В разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации. В таких растворах электропроводность растет прямо пропорционально числу ионов, которое увеличивается с концентрацией. [8]
В разбавленных растворах сильных электролитов ионы находятся на расстояниях, значительно превышающих параметр Бьеррума, между собой не взаимодействуют и при этом электролит ионизирован полностью. При повышении концентрации раствора расстояния между ионами сокращаются, что усиливает межионное взаимодействие. [9]
В случае разбавленного раствора сильного электролита более существенными будут поправочные члены, связанные с электрическими вкладами. [10]
Эквивалентная электропроводность разбавленного раствора сильного электролита ( полностью ионизированного) изменяется обратно пропорционально квадратному корню з концентрации. [11]
Электростатическая теория разбавленных растворов сильных электролитов, развитая Дебаем и Гюккелем в 1923 г., позволила теоретически вычислить средний коэффициент активности электролита, эквивалентную электропроводность сильных электролитов, а также теоретически обосновала правило ионной силы. [12]
Характер электрической проводимости разбавленных растворов сильных электролитов был объяснен Онзагером с помощью электростатической теории Де-бая и Гюккеля. [13]
Многие другие свойства разбавленных растворов сильных электролитов, например теплоемкость, рефракция, теплота реакции, могут быть более или менее точно вычислены как аддитивные, исходя из соответствующих величин для ионов и растворителя без учета недиссоциированных молекул. [14]
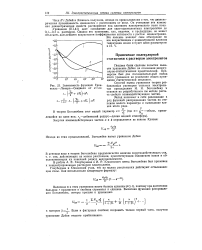 |
Зависимость функций Грон-велла - Ламера-Сандвела от xav.. [15] |
Страницы: 1 2 3 4