Более разбавленный раствор
Cтраница 2
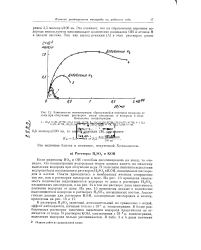 |
Зависимость концентрации образующейся перекиси водорода от. [16] |
В более разбавленных растворах кинетика выделения водорода практически не отличается от воды. [17]
В более разбавленных растворах ошибка титрования становится больше. [18]
В более разбавленном растворе процессы перестройки проходят быстрее. [19]
В более разбавленных растворах время установления потенциала может быть больше. [20]
В более разбавленных растворах щелочей, кроме воды, входящей в состав гидратных оболочек, окружающих ионы Na и ОН -, имеется и свободная вода. А с этой точки зрения, как будет показано далее, структура мерсеризованных волокон менее доступна для реагентов, чем структура нативных волокон. [21]
В более разбавленных растворах цитрата волна лучше выражена ( исчезает максимум), нов них и волна WVI начинается при более положительных потенциалах. [22]
В более разбавленных растворах азотной кислоты ( 10 - 15 % - ных), как это видно из рис. 58, потенциалы пары алюминий - сталь 1Х18Н9Т положительнее потенциалов пары алюминий - платина. Следовательно, степень усиления коррозии алюминия из-за контакта с нержавеющей сталью должна быть больше, чем в результате контакта с платиной. Объясняется это тем, что в более разбавленных растворах азотной кислоты последняя восстанавливается на нержавеющей стали легче, чем на платине. На платиновом электроде в разбавленных растворах азотной кислоты процесс деполяризации совершается за счет восстановления водорода. На нержавеющих сталях, слегка активирующихся в этих растворах, протекает более высокопотенциальный процесс восстановления ионов нитрата до азотистой кислоты. Этот процесс, как отмечено в работе [70], автокатализируется азотистой кислотой, возникающей в результате взаимодействия продуктов коррозии нержавеющей стали с ионами нитрата и водорода. [23]
В более разбавленных растворах азотной кислоты ( 10 - 15 % - ных), как это видно из рис. 58, потенциалы пары алюминий - сталь 1Х18Н9Т положительное потенциалов пары алюминий - платина. Следовательно, степень усиления коррозии алюминия из-за контакта с нержавеющей сталью должна быть больше, чем в результате контакта с платиной. Объясняется это тем, что в более разбавленных растворах азотной кислоты последняя восстанавливается на нержавеющей стали легче, чем на платине. На платиновом электроде в разбавленных растворах азотной кислоты процесс деполяризации совершается за счет восстановления водорода. На нержавеющих сталях, слегка активирующихся в этих растворах, протекает более высокопотенциальный процесс восстановления ионов нитрата до азотистой кислоты. Этот процесс, как отмечено в работе [70], автокатализируется азотистой кислотой, возникающей в результате взаимодействия продуктов коррозии нержавеющей стали с ионами нитрата и водорода. [24]
Осажденный из более разбавленного раствора. [26]
При использовании более разбавленного раствора ( 0 5 % - ный) при 100 первый остаток имел характеристическую вязкость 7 3 при меньшей скорости перемешивания п 150 об / мин. Даже в 10 % - ном растворе при 100 и 150 об / мин имела место фракционная кристаллизация ( характеристическая вязкость первого осадка [ ц ] 4), хотя этот процесс менее эффективный, чем при кристаллизации из разбавленных растворов. [27]
При использовании более разбавленных растворов ( что принципиально возможно для амперометрического титрования) могут быть определены соответственно меньшие количества вещества. [28]
При титровании более разбавленных растворов относительная ошибка титрования значительно больше, но, проводя глухой опыт, можно найти поправку на необходимый избыток реактива. Окрашенные соли, если содержание их не слишком велико, не мешают определению. [29]
Для еще более разбавленных растворов система приведенных переменных может быть найдена, исходя из концентрационной зависимости, предсказываемой простой теорией гибких цепей, изложенной в гл. [30]
Страницы: 1 2 3 4
