Моляльный раствор
Cтраница 2
Готовят некоторый объем 0 4 моляльного раствора двухромовокислого калия и приливают к нему полуторное количество ( по сравнению с теоретически рассчитанным) концентрированной серной кислоты ( что наблюдается. Полученную реакционную смесь охлаждают до 0 С. Из капельной воронки в эту смесь небольшими порциями приливают этиловый спирт ( для чего. После окончания реакции раствор оставляют на продолжительное время для кристаллизации. Выделившиеся кристаллы отделяют от маточного раствора ( каким образом. [16]
Следует помнить, что при приготовлении моляльных растворов расчет ведут именно на 1 кг растворителя, а не раствора, как в случае молярных или нормальных растворов. [17]
Приготовьте 1, 0.1 и 0 01 мольные или моляльные растворы соляной, азотной или серной кислот. [18]
Интересной особенностью обладает сульфат уранила: при нагревании его моляльного раствора до 300 С ( под давлением) жидкость разделяется на два слоя. Термическое разложение UChSCU ( a UaOe и окислы серы) наступает лишь выше 720 С. [19]
Интересной особенностью обладает сульфат уранила: при нагревании его моляльного раствора до 300 С ( под давлением) жидкость разделяется на два слоя. [20]
Следовательног можно сказать, что понижение точки замерзания всех моляльных растворов неэлектролитов в воде является величиной постоянной. Аналогичное наблюдается и для других растворителей. В связи с этим вводится понятие криоскопической константы. [21]
Смесь 8.8 г циклогексанона и 85 мл безводного эфирного 0.55 моляльного раствора НООН выдерживают 2 сут при комнатной температуре. После отгонки эфира и охлаждения остатка до О С выпадают кристаллы пероксида. [22]
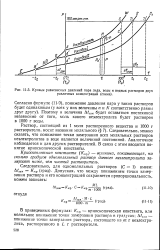 |
Кривые равновесных давлений пара льда, воды и водных растворов двух различных концентраций ( схема. [23] |
Следовательно, можно сказать, что понижение точки замерзания всех моляльных растворов неэлектролитов в воде является величиной постоянной. Аналогичное наблюдается и для других растворителей. В связи с этим вводится понятие криоскопической константы. [24]
Найти величину коэффициента г, если известно, что 0 1 моляльный раствор уксусной кислоты замерзает при - 0 19 С. [25]
ДЯИсп - моляльная теплота, растворения; Ккиа - эбуллиоскопическая постоянная моляльного раствора. [26]
Молекулярный вес ZnSO4 7Н2О равен 287 6 Для приготовления 0 2 моляльного раствора нужно 287 6 - 0 2 57 52 г на 1000 г воды. [27]
Определите криоскопическую постоянную воды, исходя из следующих данных: 0 001 моляльный раствор неэлектролита в воде замерзает при - 0 00186 С. [28]
С ростом концентрации LiCl волна водорода становится заметно по-ложительнее: в 134 - 19 моляльных растворах LiCl & /, волны разряда водорода равен - 1 1 В ( нас. [29]
ЭДС элемента, состоящего из серебряного электрода, покрытого AgCl, водородного электрода и 0 1 моляльного раствора НС1 в качестве электролита, равна 0 3316 В при 25 С и ДН2) - 0 962 бар. [30]
Страницы: 1 2 3 4