Водный раствор - иодид
Cтраница 1
Водный раствор иодида выпаривают досуха, полученную соль перекристаллизовывают при нагревании из воды без доступа воздуха. [1]
Водные растворы иодида никеля при старении окрашиваются в коричнево-красный цвет вследствие образования полииодида никеля. [2]
Водный раствор иодида натрия с примесью бромида натрия встряхивают с бромной водой, а затем подвергают упариванию и кристаллизации. В результате получается продукт, масса которого на т г меньше, чем масса использованного для опыта препарата. Этот продукт вновь растворяют в воде, через раствор пропускают хлор, упаривают и опять проводят кристаллизацию. Масса образовавшегося вещества оказывается также на т г меньше массы препарата, полученного в предыдущем опыте. [3]
Почему водный раствор желтого иодида свинца бесцветен. [4]
К водному раствору смолистых иодидов, окрашенному в темно-бурый - цвет, добавляли 250 мл 5 % - ной H2SO4 и 10 г цинковой пыли. Смесь нагревали до слабого кипения, при этом ее цвет быстро начинает светлеть. После 2-часового нагревания раствор принимает светло-желтую окраску, его сливал и с остатков цинка, охлаждали и прибавляли 25 % - ный аммиак до тех пор, пока выпавший гидрат окиси цинка не перейдет снова в раствор. Основания выделяются при этом в виде светло-желтых хлопьев, которые 4 раза извлекали эфиром. [5]
Если насыщать водный раствор иодида олова концентрированной HI ( 0), можно выделить желтые игольчатые кристаллы трииодо-оловянистой кислоты H [ SnI3 ], устойчивые только в конц. [6]
Лучше растворяется в водных растворах иодида и бромида калия. [7]
Наши опыты показали, что при добавлении водного раствора иодида кадмия к слабокислому разбавленному раствору перхлората висмута образуется черный или бурый осадок, который затем растворяется при дальнейшем добавлении очень большого избытка иодида кадмия с образованием зеленовато-бурого раствора при повышенных количествах висмута и зеленовато-желтого раствора при маленьких количествах висмута. [8]
Зависимости Csm f ( X2) для водных растворов иодидов тетрабутилам-мония ( рис. 30, в) до Х2 5 Ю-4 симбатны рассмотренным выше, но при Хг 5 10 - 4 наблюдается минимум растворимости газа, появление которого связано с резким ростом размеров ионов ( C4H9) 4N и усилением их разрушающего действия на структуру воды. [9]
Раствор субстрата в толуоле перемешивают при 90 С с водным раствором иодида натрия ( 10 мол. [10]
Особый интерес при рассмотрении зависимостей Csm f ( X) для водных растворов иодидов тетраалкиламмония представляет, на наш взгляд, аномальное смещение максимума растворимости аргона с ростом размеров радикалов R. При переходе от ( СН3) 4 к ( С2Н5) 4М максимум смещается в область больших концентраций электролита, а при переходе от ( C2H5) 4N к ( C4H9) 4N - в область меньших концентраций соли. [11]
На рис. 30, а представлены зависимости растворимости аргона от концентрации соли в водных растворах иодида тетраметиламмония при температурах 273 - 298 К. Из рисунка видно, что при 273 - 288 К зависимости Csm f Xi) в районе Х2 6 Ю-4 проходят через максимум. [12]
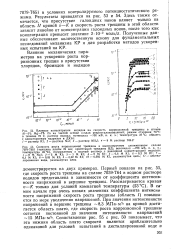
Первый показан на рис. 55, где скорость роста трещины на сплаве 7039 - Т64 в водном растворе иодидов представлена в зависимости от коэффициента интенсивности напряжений в вершине трещины. В самом начале при очень низких значениях коэффициента интенсив ности напряжений скорость роста трещины ( область /) повышается по мере увеличения напряжений. [14]
Финкелыптейн и Кляев [66], исследовав механизм восстановления акрилонитрила, обнаружили, что на фоне 0 1 М водного раствора иодида тетраэтиламмония этот мономер образует полярографическую необратимую волну с Et / 2 - 1 950 в, при этом он подвергается одноэлектронному восстановлению с образованием адипонитрила. Замедленной стадией процесса является перенос электрона. [15]
Страницы: 1 2