Водный раствор - комплекс
Cтраница 1
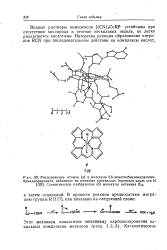 |
Расположение атомов ( а в молекуле 5 6-диметилбензимидазолко. [1] |
Водные растворы комплексов [ ( CN) 5CoR ] 3 - устойчивы при отсутствии кислорода в течение нескольких недель, но легко разлагаются кислотами. [2]
Водный раствор комплекса облучают медленными нейтронами, а затем к раствору добавляют 30 % роданистого калия. Радиоактивный кобальт переходит в спиртовую фазу. [3]
Если водный раствор комплекса характеризуется кислой или щелочной реакцией, то нужно вносить поправку на долю участия ионов Н или ОН в общей величине электропроводности. [4]
Для водных растворов комплексов с лигандами указанного типа это означает, что измеряемое время релаксации состоит из двух слагаемых, первое из которых отражает релаксацию протонов воды, а второе - релаксацию протонов молекулы лиганда. [5]
Для водных растворов комплексов Fe3 характерна реакция полимеризации путем образования димерных оксо - и дигидроксо-мостиковых структур. [6]
Если к желто-оранжевому водному раствору пирокате-хинатного комплекса молибдена прибавить пиридин, никакого заметного изменения окраски не происходит. Однако если эту смесь встряхивать с хлороформом, последний окрашивается в красно-фиолетовый цвет. Очевидно, образуется пирокатехинатно-пиридиновый комплекс молибдена, не способный существовать в водном растворе. Для развития окраски максимальной интенсивности необходим довольно большой избыток пиридина по отношению к пирокатехину. Однократной экстракцией не удается перевести весь молибден в новый комплекс. [7]
При термической обработке водных растворов комплексов платиновых металлов получаются соответствующие сульфиды. На этом основано применение тиомочевины в качестве коллективного реагента на все платиновые металлы. Следует отметить, что разложению тиомочевинных комплексов до сульфидов платиновых металлов в водных растворах способствует гидролиз. [8]
Если один из образующихся в водном растворе комплексов ВА является электронейтральным, то его можно избирательно экстрагировать несмешивающимся органическим растворителем. При этом определение влияния концентрации свободного лиганда на равновесное распределение приводит, в принципе, к нахождению констант устойчивости комплексов ВАП в водной фазе. [9]
Метод основан на экстрагировании хлороформом вд водного раствора комплекса ПАВ с азокрасителем оранжевый II и последующем спектрофотометрическом анализе при Я 485 нм. Определение осуществляют, пользуясь калибровочным графиком. [10]
На основании ИК - и УФ-спектров водных растворов комплексов бериллия с вышеназванными кислотами предложен возможный механизм комплексообразования. [11]
Метод основан на экстрагировании хлороформом из водного раствора комплекса ПАВ с азокрасителем оранжевым П и последующем спектрофо-тометрическом анализе комплекса при X 486 нм. [12]
Другие галогены не образуют устойчивых в водном растворе комплексов с элементами третьего периода. [13]
До сих пор считали, что для водных растворов комплексов платины ( II) амидореакция не является характерной. [14]
В табл. 3.8 представлены значения IgK и К водных растворов комплексов основных краун-эфиров, опубликованные вплоть до 1976 г., а также величины К комплексов с этилендиаминтетрауксусной кислотой [ ( HOOCH2C) 2NCH3CH2N ( CH2COOH) 2 ] - известным комплексообразующим реагентом. [15]
Страницы: 1 2 3