Водный раствор - соль
Cтраница 1
Водные растворы солей в зависимости от их состава и величины рН оказывают различное коррозионное действие на магний и его сплавы. Растворы, содержащие ионы хлора, вызывают более значительную коррозию, чем растворы с сульфат-или нитрат-ионами, так как на металлической поверхности образуется очень пористая пленка. Магний и его сплавы, за исключением специальных сплавов с высоким содержанием марганца, корродируют в морской воде. При одинаковом содержании хлорида натрия скорость коррозии в морской воде значительно выше, чем в чистом растворе хлорида натрия из-за наличия в морской воде агрессивных сульфат-ионов. Нейтральные и щелочные растворы фторидов не агрессивны по отношению к магнию и его сплавам вследствие образования защитной пленки. [1]
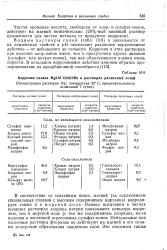 |
Коррозия сплава Mg6Al. ZnO 2Mn в растворах различных солей. [2] |
Водные растворы солей ( табл. 10.9) в зависимости от их химических свойств и рН оказывают различное коррозионное действие - от небольшого до сильного. Коррозия в этих растворах при наличии хлор-ионов выше, чем в присутствии других анионов ( сульфат - или нитрат-ионов), так как образующиеся пленки очень пористы. [3]
Водные растворы солей ( холодильные рассолы) используются как охлаждающие агенты в области температур, более низких, чем температура замерзания воды. В промышленных установках находят применение водные растворы хлоридов натрия, кальция и магния. Выбор соли и ее концентрации в растворе зависит от минимальной температуры холодильной установки. [4]
Водные растворы солей после первой ( в сборнике 3) и второй ( в сборнике 10 после регенерации спирта) ступеней разложения соединяют, нагревают до 102 - 103 С для перевода бикарбоната натрия в карбонат и возвращают на омыление окисленного парафина. Этим достигается экономия соды. После этого насыщенные солями щелочные растворы должны быть выведены из процесса. Из них выделяют кислоты пятой фракции разложением солей серной кислотой и. [5]
Водные растворы солей, образованных этими кислотами, в значительной степени подвергаются гидролизу. [6]
Водный раствор соли, образованной катионом слабого основания и анионом слабой кислоты, может иметь слабокислую, слабощелочную или нейтральную реакцию. Это зависит от степени диссоциации образовавшихся в результате гидролиза кислоты и основания. Соли этого типа подвергаются гидролизу относительно легко. [7]
Водный раствор соли AI2S3 получить нельзя, так как она мгновенно разлагается вследствие гидролиза. [8]
Водные растворы солей, кислот и оснований обнаруживают еще одну очень важную особенность: они проводят электрический ток. Поэтому указанные вещества называются электролитами в отличие от неэлектролитов - веществ, растворы которых не проводят электрического тока. [9]
Водные растворы солей могут иметь нейтральную кислую и щелочную реакцию. [10]
Водный раствор соли, образованной катионом слабого основания и анионом слабой кислоты, может иметь слабокислую, слабощелочную или нейтральную реакцию. Это зависит от относительной силы образовавшихся в результате гидролиза кислоты и основания. Соли этого типа подвергаются гидролизу относительно легко. [11]
Водные растворы солей гафния являются сложными химическими системами, в которых в равновесии с растворенным веществом и растворителем находятся продукты их взаимодействия. В водных растворах в присутствии минеральных кислот такими продуктами будут комплексные соединения, например фторидные, хлоридные, сульфатные и другие, а также продукты их гидролиза. Вследствие небольшого размера и высокого заряда ион Hf4 1 в водных растворах легко гидролизуется, образуя гидроксо-ионы различного состава, которые, в свою очередь, образуют полиядерные гидроксоком-плексы. [12]
Водные растворы солей мышьяковой H3AsO4 и мышьяковистой H3AsO3 кислот содержат анионы AsO4 - и АзОз -, которые при подкислении раствора соляной кислотой переходят в катионы мышьяка. [13]
Водные растворы солей могут иметь нейтральную, кислую или щелочную реакцию. [14]
Водные растворы солей, кислот и оснований обладают еще одной особенностью - они проводят электрический ток. При этом безводные твердые соли и основания, а также безводные кислоты тока не проводят; почти не проводит тока и чистая вода. Очевидно, что при растворении в воде подобные вещества подвергаются каким-то глубоким изменениям, которые и обусловливают электропроводность получаемых растворов. Как мы увидим ниже, эти изменения заключаются в диссоциации соответствующих веществ на ионы. [15]
Страницы: 1 2 3 4