Водный раствор - соль
Cтраница 2
Водные растворы солей, кислот и оснований обладают еще од-кой особенностью - они проводят электрический ток. При этом безводные твердые соли и основания, а также безводные кислоты тока не проводят; почти не проводит тока и чистая вода. Очевидно, что при растворении в воде подобные вещества подвергаются ка-ким-то глубоким изменениям, которые и обусловливают электропроводность получаемых растворов. Как мы увидим ниже, эти изменения заключаются в диссоциации соответствующих веществ на ионы. [16]
Водные растворы солей могут иметь нейтральную, кислую или щелочную реакцию. Кислую реакцию дают растворы солей, образованных катионами слабых оснований и анионами сильных кислот; щелочную реакцию имеют водные растворы соединений, образованных анионами слабых кислот и катионами сильных оснований. Явление это обусловлено взаимодействием ионов указан-ных солей с ионами воды, его называют гидролизом. [17]
Водные растворы солей Со имеют розовую окраску. [18]
Водный раствор соли ( 1: 20) не должен изменяться от прибавления сероводородной воды или раствора азотнобариевой соли; не должно также происходить изменения при прибавлении к 4 куб. [19]
Водный раствор соли, подкисленный азотной кислотой, дает с раствором азотнокислого серебра белый осадок хлористого серебра. [20]
Водные растворы солей, образованных этими t кислотами, в значительной степени подвергаются гидролизу. [21]
Водные растворы солей изучаются с давних пор. Накопленный экспериментальный материал позволяет дать сравнительно полную термодинамическую характеристику насыщенных водных растворов солей. Набор параметров при этом может быть самым разнообразным. Если говорить о минимальном наборе параметров, то, с нашей точки зрения, наиболее целесообразна характеристика из пяти параметров, которые отнесем к 25 С. [22]
Водные растворы соли глифосата с изопропиламином при хранении корродируют различные металлы, в связи с чем их хранение возможно только в металлической таре со специальным антикоррозионным покрытием или в полиэтиленовой таре. [23]
Водные растворы соли глифосата с иэопропиламином при хранении корродируют различные металлы, в связи с чем их хранение возможно только в металлической таре со специальным антикоррозионным покрытием или в полиэтиленовой таре. [24]
Водные растворы солей при высоких температурах, а следовательно, и при высоких давлениях обладают способностью растворять в значительной мере те вещества, и в частности минералы, которые в чистой воде практически нерастворимы. [25]
Водные растворы солей Сг3 1, полученные растворением металлического хрома в разбавленных кислотах или восстановлением бихроматов различными восстановителями в кислой среде, окрашены в фиолетовый или зеленый цвет. [26]
Водные растворы солей и щелочей - в определенных концентрациях вызывают коагуляцию промывочных жидкостей и их остатков и затрудняют тем самым их удаление. Они изменяют также и сроки схватывания. [27]
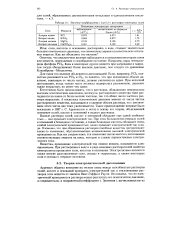 |
Значение коэффициента г для 0 2 н растворов некоторых солей. [28] |
Водные растворы солей, кислот и оснований обладают еще одной особенностью - они проводят электрический ток. При этом большинство твердых солей и оснований в безводном состоянии, а также безводные кислоты обладают очень слабой электрической проводимостью; плохо проводит электрический ток и вода. Очевидно, что при образовании растворов подобные вещества претерпевают какие-то изменения, обусловливающие возникновение высокой электрической проводимости. Как мы увидим ниже, эти изменения заключаются в диссоциации соответствующих веществ на ионы, которые и служат переносчиками электрического тока. [29]
Водные растворы солей электропроводны и не могут применяться для тушения электрооборудования, находящегося под током. [30]
Страницы: 1 2 3 4