Водный раствор - соль - алюминий
Cтраница 1
Водные растворы солей алюминия обнаруживают вследствие гидролиза кислую реакцию. Так как нон алюминия сшгыю гидроли-зуется, большинство реагентов осаждает алюминий из растворов в виде гидроокиси алюминия. Присутствие органических оксикис-лот - винной, лимонной, малеиновой - препятствует осаждению иона А13, так как в их присутствии алюминий образует хелатное, соединение. [1]
Водные растворы солей алюминия содержат бесцветные ионы А13, в значительной степени гидратированные. [2]
К водному раствору соли алюминия добавляют раствор AgNCb. Осадка не образуется, следовательно, отсутствуют анионы I группы. При добавлении к новой порции раствора нитрата бария выпадает белый осадок, нерастворяющийся при добавлении к нему HCI. Следовательно, в растворе присутствуют § 04 -ионы. [3]
При электролизе водных растворов солей алюминия основа на катоде в виде металла не выделяется. Образующаяся гидроокись способна адсорбироваться на угольном диске. Наши опыты показали, что при электролизе, например, раствора азотнокислого алюминия за 15 - 30 минут на диске образуется 0 5 - 1 мг осадка. Большую часть осадка можно смыть дистиллированной водой; однако некоторое количество в виде плотно прилипающей пленки удалить таким способом не удается. [4]
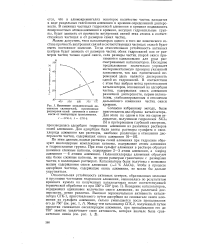 |
Изменение каталитической активности силикагелей, пропитанных растворами солей алюминия в зависимости от температуры прокаливания. [5] |
По этим данным, водные растворы солей алюминия при гидролизе образуют многоядерные комплексные катионы, содержащие атомы алюминия и гидроксильные группы. При этом сульфат алюминия в растворе образует наименее сложные катионы, содержащие 2 - 3 атома алюминия, а хлорид алюминия - 6 атомов алюминия. Полно ксихлориды алюминия образуют еще более сложные катионы, по своим размерам граничащие с размерами частиц в коллоидных растворах. Катализаторы были получены с возможно малым содержанием окиси алюминия ( - 1 % АЬОз), чтобы в процессе адсорбции частицы, содержащие окись алюминия, не могли бы дальше укрупняться. [6]
Таким образом, кислая реакция водных растворов солей алюминия и железа объясняется отщеплением протона от гидрати-рованного иона металла. [7]
Рассмотрите подробно характер процессов, происходящих при сливании водных растворов соли алюминия и сульфида аммония. [8]
Для получения диантипирилметана высокой степени чистоты его перекристаллизовывают из этанола с добавлением небольших количеств водного раствора соли алюминия и затем аммиака; выделившаяся при этом гидроокись алюминия играет роль коллектора. [9]
Гидроксид алюминия А1 ( ОН) з выпадает в виде студенистого осадка при действии щелочей на водные растворы солей алюминия. [10]
Измеримую скорость обмена между молекулами растворителя - воды и сольват-ной оболочкой катиона наблюдали [42], смешивая водный раствор соли алюминия с водой ( содержащей Н2180) в простой аппаратуре ( подобной той, которая показана на рис. 5) и останавливая обмен выливанием раствора в охлажденный пентан. Было найдено, что время полупревращения реакции обмена составляет более 0 02 сек, а энергия активации, вероятно, порядка 20 ккал - моль 1 ( ср. Преимущество метода остановки реакции заключается в том, что он требует лишь простой аппаратуры и позволяет, следя за реакцией химически, использовать стандартные точные аналитические методы. С другой стороны, его можно применять только в том случае, если можно найти быстрый способ остановки реакции; кроме того, для получения кинетической кривой необходима серия опытов. [11]
Для совместной очистки от оксидов азота и серы предложен процесс с подачей озона и применением в качестве абсорбента воды ( или смеси разбавленных серной и азотной кислот) или водных растворов солей алюминия. [12]
В ряду напряжений легкие металлы расположены значительно ниже водорода и их не удается выделить электролизом из водных солей по аналогии с медью, никелем и цинком, так как на катоде при электролизе водных растворов солей алюминия, магния и других легких металлов выделяется водород. Поэтому многие легкие металлы получают электролизом расплавленных солей, не содержащих ионов водорода. Кроме того, электроотрицательный характер легких металлов предъявляет очень высокие требования к чистоте всех материалов, поступающих на электролиз. [13]
Сульфиды алюминия, хрома и титана легко гидролизуются, поэтому могут быть получены только в сухом виде. При действии группового реактива на водные растворы солей алюминия, хрома и титана выпадают не их сульфиды, а гидроокиси. [14]
При этом можно предположить, что диссоциативное взаимодействие происходит между протоном одной из шести молекул первой ( внутренней) координационной сферы аквакомплекса алюминия с молекулой воды второй сферы с одновременным отщеплением и второй молекулы воды наружной сферы. Отщепление протона обусловливает кислую реакцию водных растворов солей алюминия. [15]
Страницы: 1 2 3