Насыщенный раствор - вещество
Cтраница 1
Желтый насыщенный раствор вещества Х1а в ледяной уксусной кислоте при кипячении на солнечном свету быстро окрашивается в зеленый цвет; одновременно с этим выпадают кристаллы. Раствор фильтруют, после чего с помощью лупы можно отчетливо различить наряду с тонкими иглами нафтодиантрона плотные компактные кристаллы дегид-родиантрона. [1]
Если насыщенный раствор вещества, растворимость которого уменьшается с понижением температуры, постепенно охлаждать, не давая возможности образоваться пересыщенному раствору, то начнется кристаллизация растворенного вещества. [2]
Если необходимо приготовить насыщенный раствор вещества, растворимость которого в воде неиз-вестна, вещество добавляют небольшими порциями, каждый раз добиваясь полного растворения, до тех пор, пока последняя порция уже не будет растворяться. Следует иметь в виду, что с повышением концентрации раствора скорость растворения падает. Поэтому быть уверенным, что состояние насыщения достигнуто, можно лишь в том случае, если количество твердого вещества не уменьшилось после по крайней мере получасового перемешивания раствора. [3]
Это уравнение выражает, что насыщенный раствор вещества при данной температуре обладает постоянной концентрацией, которая называется растворимостью вещества при данной температуре. Это относится и к ненасыщенным растворам. Если мы прибавим кристалл твердой фазы к пересыщенному раствору, выпадет осадок и образуется насыщенный раствор. Некоторые соли легко образуют пересыщенные растворы, а так как образование твердой фазы ( оса-жденве) некоторых из таких веществ часто применяется как реакция обнаружения, аналитик должен предупреждать образование пересыщенных растворов. Это достигается перемешиванием раствора и потиранием палочкой о стенки сосуда с целью вызвать образование кристаллов. Наиболее легко вызвать осаждение из пересыщенного раствора внесением в раствор маленького кристалла растворенного вещества. [4]
Количественной характеристикой растворимости является концентрация насыщенного раствора вещества при данной температуре. [5]
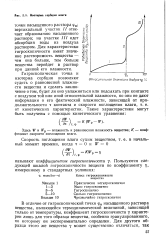 |
Изотерма сорбции влаги. [6] |
В отличие от гигроскопической точки фн насыщенного раствора вещества, являющейся термодинамической величиной, зависящей только от температуры, коэффициент гигроскопичности Y характерен лишь для того образца вещества, особенно гранулированного, по которому он экспериментально определен. [7]
 |
Изотерма сорбции в логарифмических координатах. [8] |
В отличие от гигроскопической точки срн насыщенного раствора вещества, являющейся термодинамической величиной, зависящей только от температуры, коэффициент гигроскопичности у характерен лишь для того образца вещества, особенно гранулированного, по которому он экспериментально определен. Для другого образца этого ж: е вещества у может существенно отличаться из-за неодинаковой структуры ( пористости) и прочности ( твердости) гранул, что зависит от способа гранулирования. [9]
Иногда применяется метод, основанный на медленном разбавлении насыщенного раствора вещества в одной жидкости другой жидкостью, которая не растворяет данное вещество. [10]
Уравнение ( V, 3) равновесия в насыщенном растворе вещества МА показывает, что всякое повышение концентрации Мп или А сверх равновесной, сопровождается осаждением новых порций МА. Это означает, что при внесении в насыщенный раствор МА другого вещества, например М А, которое содержит общий с осадком ион, растворимость МА начнет уменьшаться. [11]
Очевидно, что при изотермической перегонке дисперсионная среда представляет собой насыщенный раствор вещества дисперсной фазы. [12]
X в единице объема, твердой фазы, при определенной температуре постоянно, то оче-видно, что при равновесии между двумя фазами в насыщенном растворе вещества X его концентрация Схж-однозначно определенная величина, зависящая только от температуры, но не от количества твердой фазы, присутствующей в системе. [13]
Набухший гель по своему строению не однороден, а состоит из двух фаз: 1) ассоциированной фазы - коллоидных гидратиро-ванных частиц - и 2) насыщенного раствора вещества коллоида в воде. В ассоциированной фазе частицы вещества связаны молекулярными силами в общую сплошную структуру и образуют губ-кообразный каркас, придающий всей системе некоторую механическую прочность. Капилляры между волокнами каркаса заполняются раствором более растворимой фракции данного вещества. В таком студнеобразном геле связи между полярными группами в результате их гидратации почти полностью нарушаются, а остаются действующими лишь связи между углеводородными цепями. Эти связи при повышении температуры ослабевают, что обусловливает резкое увеличение набухания. Так, при повышении температуры студня желатина на 10 С объемный эффект набухания возрастает приблизительно в два раза. При дальнейшем повышении температуры студень расплавляется без резко выраженной точки плавления, т.е. вязкость студня с повышением температуры постепенно понижается, и студень переходит в жидкое состояние. [14]
Каждой температуре соответствует определенная растворимость данного вещества. Если охладить насыщенный раствор вещества, ( растворимость которого с температурой повышается, то растворенное вещество выпадает в осадок в таком количестве, что раствор остается насыщенным при той температуре, до которой он охлажден. Однако в некоторых случаях при медленном охлаждении растворенное вещество не выделяется. Тогда говорят, что раствор пересыщен. Но это очень неустойчивое состояние раствора-достаточно какому-нибудь кристаллику или пылинке попасть в раствор, чтобы избыток соли вьглал в осадок. [15]
Страницы: 1 2