Растворение - хлористый калий
Cтраница 2
Следует отметить, что энтальпийная и энтропийная составляющие изобарно-изотермического потенциала действуют на процесс растворения хлористого калия в противоположных направлениях. Во всем исследованном диапазоне концентраций электролита энтальпийные составляющие противодействуют, а энтропийные - благоприятствуют этому процессу. [16]
Кривые АОраствf ( m) находятся в отрицательной зоне, и величины изменений изобарно-изотермического потенциала при растворении хлористого калия в смешанных растворителях вода-метиловый спирт с ростом концентрации электролита по абсолютной величине уменьшаются, принимая нулевое значение для насыщенных растворов. Это уменьшение происходит тем быстрее, чем больше метилового спирта содержится в смешанном водно-спиртовом растворителе. [17]
При помощи микрокалориметра переменной температуры с изотермической оболочкой и автоматической записью результатов с точностью 0 3 % измерены изменения энтальпии при растворении хлористого калия в смешанных растворителях вода - метиловый спирт, содержащих 0 059 - 0 458 мольных долей СН3ОН, в области моляльных концентраций электролита от 0 01 до близких к насыщению при 25 С. Вычислены изменения изобарно-изотермического потенциала и энтропии указанных процессов. [19]
Общепринятое значение теплоты образования хлористого калия ДЯ7298Л6 - 104 175 ккал / моль было вычислено Россини и др. [813, 3508] на основании критического анализа данных по теплоте растворения хлористого калия, теплоте растворения металлического кали в воде и теплоте нейтрализации растворов едкого кали соляной кислотой. [20]
Степень насыщения щелока и количество нерастворенного хлористого калия в отвале зависят от принятого режима растворения, которое осуществляют противотоком, прямотоком и по комбинированным схемам. При оценке эффективности различных режимов растворения необходимо учесть также происходящее при растворении хлористого калия в щелоке высаливание из него хлористого натрия - выделение шлама мелких кристаллов NaCl. Шламообра-зование отрицательно сказывается на показателях процесса в целом, так как при этом возрастают нагрузка на аппаратуру для отстаивания и обработки шламов и потери калия с отвалом. [21]
Степень насыщения щелока и количество нерастворенного хлористого калия в отвале зависят от принятого режима растворения, которое осуществляют противотоком, прямотоком и по комбинированным схемам. При оценке эффективности различных режимов растворения необходимо учесть также происходящее при растворении хлористого калия в щелоке высаливание из него хлористого натрия - выделение шлама мелких кристаллов NaCl. Шламообразование отрицательно сказывается на показателях процесса в целом, так как при этом возрастают нагрузка на аппаратуру для отстаивания и обработки шламов и потери калия с отвалом. [22]
Способы, в которых часть хлористого калия получается в виде шлама, а часть в результате кристаллизации, называются комбинированными. Наиболее распространенный из них называется способом неполного растворения, так как по этому способу карналлит обрабатывают водой, взятой в количестве, недостаточном для растворения всего хлористого калия. [23]
При растворении хлористого лития энергия, необходимая для разрушения кристаллической решетки, с избытком покрывается энергией гидратации. Таким образом создаются и непрерывно поддерживаются условия, необходимые для растворения, которое протекает с выделением тепла. При растворении хлористого калия тепла гидратации недостаточно для разрушения его кристаллической решетки. Необходимое для этого тепло частично доставляется извне. На примере растворения КС1 можно видеть, какое значение имеет член T &. В соответствии с уравнением (1.3), полученные величины указывают на способность КС1 к растворению. Такая способность не обнаружена у фтористого кальция, что обусловлено большим дефицитом энергии. [24]
Следовательно, при растворении, с одной стороны, энергия затрачивается на разрыв связей между молекулами или ионами растворяемого вещества, с другой стороны, энергия выделяется за счет взаимодейств ия частиц растворенного вещества и молекул растворителя. Значит, выделение или поглощение тепла при растворении является результатом этих двух процессов. Например, при растворении хлористого калия идет как поглощение тепла, так и его выделение. [25]
При температуре раствора 60 - 70 С в бак постепенно вводят измельченный хлористый калий. По мере загрузки и растворения хлористого калия производится определение плотности раствора и измерение его температуры. [26]
Для утилизации тепла сокового пара на заводе смонтирована установка для конденсации этого пара в двух последовательно включенных конденсаторах смешения. По новой схеме в первом по ходу сокового пара конденсаторе вода нагревается до 60 - 80 С и используется для растворения соли на фильтрах и для растворения хлористого калия для электролиза. Несконденсировавшаяся часть пара поступает во второй конденсатор, в котором конденсируется полностью. В результате годовая экономия тепловой энергии определяется более чем в 10 тыс. Гкал. [27]
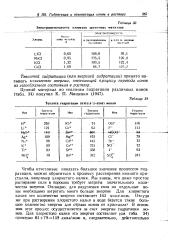 |
Электропроводность хлоридов щелочных мета мое.| Теплота гидратации ( ккал г-пон ионов. [28] |
Мы знаем, что даже простое растирание соли в порошок требует затраты значительного количества энергии. Очевидно, для разделения соли на отдельные ионы необходимо затратить много больше энергии Для хлористого калия это количество энергии составляет 163 кхал / моль. Откуда же при растворении хлористого калия в воде берется такое большое количество энергии для отрыва ионов от кристалла. В основном этот процесс осуществляется за счет энергии гидратации ионов. [29]
 |
Теплота гидратации ионов АЯ. [30] |
Страницы: 1 2 3
