Растворение - кремний
Cтраница 3
Близость этих двух значений позволила автору придти к заключению, что в отличие от германия дырки, участвующие в растворении электронного кремния, образуются в зоне пространственного заряда, а не в объеме полупроводника. [31]
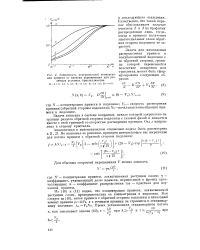 |
Зависимость поверхностной концентрации примеси от времени наращивания при различных условиях кристаллизации. [32] |
Задача записана в системе координат, начало которой закреплено на границе раздела обратной стороны подложки с газовой фазой и движется вместе с этой границей со скоростью растворения кремния. Ось х направлена в сторону кристалла. [33]
Навеску растертого в порошок кремния 1 г помещают в платиновую чашку, приливают 10 - 13 мл концентрированного раствора гидроокиси натрия и нагревают на водяной бане до растворения кремния, периодически покачивая чашку. В ходе растворения несколько раз прибавляют по 2 - 3 мл воды для возмещения испарившейся. Полученный раствор переносят с помощью 30 мл воды в колбу прибора для выделения арсина, приливают 15 мл хлористоводородной кислоты, 2 мл 15 % - ного раствора иодида калия и 0 5 мл раствора хлорида олова ( II) и оставляют на 15 мин. [34]
Для приготовления золей с содержанием до 50 % SiO2 посредством растворения кремния Бобб [114] предложил использовать водный раствор неорганического основания ( NaOH, КОН), который катализирует растворение кремния при 50 - 100 С и стабилизирует получающийся золь. Примечательно то, что золи, приготовленные при 90 - 95 С, оказывались очень вязкими, но имели обычную низкую вязкость, если готовились при 98 - 100 С. [35]
По этой причине, с одной стороны, устойчивость аустенита и прокаливаемость стали возрастают благодаря увеличению легированности - твердого раствора кремнием, а с другой-уменьшаются из-за искажений кристаллической решетки, возникающих при растворении кремния. Вследствие противоположного действия этих двух факторов при растворении кремния в стали его результирующее положительное влияние на прокаливаемость ( с увеличением количества крейния в стали) уменьшается. [36]
То обстоятельство, что дырки, участвующие в анодном растворении кремния, образуются в области пространственного заряда полупроводника на границе с электролитом, находит косвенное подтверждение в действиях добавок восстановителей и окислителей на анодный процесс растворения кремния п-типа. [37]
В платиновый тигель емкостью - - 10 мл помещают 0 2 г препарата ( кремния), взятые с точностью до 0 001 г. Прибавляют 0 2 мл раствора маннита, 0 2 мл раствора нитрата серебра, 2 мл перекиси водорода ( порциями по 0 5 мл, по мере растворения кремния, продолжающегося 2 - 4 часа), 5 мл раствора фтористоводородной кислоты, хорошо перемешивают, плотно накрывают платиновой крышкой и выдерживают на нагретой до 90 водяной бане до полного растворения кремния. [38]
При концентрировании двуокись кремния растворяется во фтористоводородной кислоте, а кремний - во фтористоводородной кислоте в присутствии перекиси водорода ( пергидроля) в качестве окислителя. Реакция растворения кремния в смеси фтористоводородной кислоты и пергидроля катализируется хлорной медью. [39]
Происходит ли растворение кремния. [40]
Вплавлсние контактов осуществляется в течение нескольких минут при температуре 550 С, меньшей температуры образования жидкой фазы. Эта операция приводит к растворению кремния в алюминии и диффузии атомов кремния вдоль алюминиевых полосок на значительные расстояния. Термообработка алюминия зачастую ведет к его рекристаллизации и к образованию в результате локальных утолщений в пленке. Считается, что появление таких утолщений связано с наличием в осажденных пленках, механических напряжений. Утолщения могут создавать трудности при последующем нанесении диэлектрика. Пленки алюминия, содержащие 1 % кремния, менее подвержены образованию крупных утолщений. [41]
Кремний растворяется в растворах гидроокиси; калия или гидроокиси натрия и в смеси азотной и плавиковой кислот. На анодных участках протекает реакция растворения кремния с образованием SiO2; на катодных - процесс выделения водорода. Наиболее вероятно, что катодная реакция связана с захватом электронов непосредственно из валентной зоны полупроводника. Освобождающиеся при этом дырки во много раз ускоряют анодную реакцию. В пользу электрохимического механизма растворения кремния свидетельствует также влияние анодной и катодной поляризации на скорость саморастворения. Подача анодного потенциала на кремний резко снижает скорость саморастворения, оказывая тормозящее влияние на сопряженную катодную реакцию выделения водорода. В то же время на анодных участках резко возрастает скорость образования SiC2, которая не успевает растворяться в электролите и покрывает поверхность электрода. При подаче катодного потенциала скорость растворения кремния возрастает. При этом заметно облегчается катодная реакция, а также частично восстанавливаются трудно удаляемые с поверхности окислы кремния. [42]
В отличие от компактного германия, растворение кремния происходит легко даже в виде грубых зерен, хотя в этом случае и требуется несколько больший расход кислот-растворителей. [43]
Чип-мен и Грант [51] определили теплоту растворения кремния в жидком железе, наблюдая повышение температуры при добавке кремния к жидкому железу в индукционной печи. Количество железа при этих опытах было достаточно велико ( 45 кг) и отношение поверхности к массе было благоприятным. В результате теплообмен между жидким сплавом и окружающими телами был небольшим, несмотря на отсутствие каких-либо специальных мер. [44]
По этой причине, с одной стороны, устойчивость аустенита и прокаливаемость стали возрастают благодаря увеличению легированности - твердого раствора кремнием, а с другой-уменьшаются из-за искажений кристаллической решетки, возникающих при растворении кремния. Вследствие противоположного действия этих двух факторов при растворении кремния в стали его результирующее положительное влияние на прокаливаемость ( с увеличением количества крейния в стали) уменьшается. [45]
Страницы: 1 2 3 4