Растворение - пассивный металл
Cтраница 2
Пассивирующие слои на металле не являются вполне устойчивыми по отношению к раствору. Поэтому стационарное состояние при растворении пассивного металла характеризуется параллельно протекающими реакциями образования и растворения пассивирующего слоя. [16]
Перхлорат-ионы, способные при достаточно высокой концентрации подавлять ими же вызываемую активацию в области потенциалов от 0 8 до 1 4 в, совершенно не в состоянии воспрепятствовать другому процессу анодного активирования, который начинается при ф 1 4 в. Однако перепассивация приводит лишь к неболыпоТиу повышению скорости растворения пассивного металла. Это явление происходит, по-видимому, и при концентрациях перхлората 10 4 - 10 3 молъ / л, но прирост плотности тока, вызванный перепассивацией в этих условиях, вероятно, столь незначителен по сравнению с общей скоростью растворения, что обнаружить его на поляризационных кривых не удается. [17]
Пассивность металла может непрерывно возрастать с увеличением потенциала электрода и соответственно поверхностной концентрации кислорода. Лишь в первый момент времени с увеличением потенциала скорость растворения пассивного металла возрастает, качественно в согласии с законами электрохимической кинетики; затем, вследствие возрастания поверхностной концентрации кислорода, скорость растворения при том же потенциале вновь уменьшается. Конечная скорость растворения мо - - жет совпадать, а может и отличаться от той, что была при менее положительном потенциале. [18]
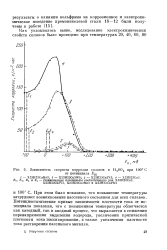 |
Зависимость скорости коррозии сплавов в H2S04 при 100 С. [19] |
При этом было показано, что повышение температуры затрудняет возникновение пассивного состояния для всех сплавов. Потенциостатические кривые зависимости плотности тока от потенциала показали, что с повышением температуры облегчается как катодный, так и анодный процесс, что выражается в снижении перенапряжения выделения водорода, увеличении критической плотности тока пассивирования, а также увеличении плотности тока растворения пассивного металла. [20]
По пленочной теории пассивности [60, 76] принимается, что в стационарном состоянии общий ток пассивного металла является током растворения ионов металла, которые переходят в раствор из пассивной пленки. При этом толщина пленки не изменяется, и анодный ток расходуется лишь на компенсацию ее растворившейся части. Таким образом объясняется независимость скорости растворения пассивного металла от потенциала. Согласно [63, 77], стационарный ток растворения пассивного титана расходуется главным образом на прямой переход ионов титана, мигрирующих через окисную пленку на границу пленка - электролит. Лишь небольшая доля тока расходуется на возобновление растворившейся части пленки. Приведенные выше результаты подтверждают это предположение. [21]
Таким образом, явление пассивности состоит в повышении перенапряжения или замедлении процесса ионизации металлов вследствие изменения заряда и свойств поверхности, вызванных образованием на ней адсорбционных или фазовых слоев окислов. Часто полагают, что основное различие между адсорбционной и пленочной теориями сводится к вопросу о количестве пассивирующего окислителя или форме его существования на поверхности. Единственно четкая граница между двумя теориями может быть проведена в вопросе о механизме растворения пассивного металла. [22]
Нашим традиционным направлением в области пассивности является сравнительное изучение электрохимического поведения пассивных металлов и их окислов. Это направление представлено в разделах, посвященных молибдену, титану, платине, кобальту и никелевым сплавам. Кроме того, в книгу включены результаты исследования механизма действия кислородсодержащих анионов СгО -, МпО и C10J на кинетику растворения пассивного железа в сернокислых растворах. Помимо обычного потенциостатическог метода, в1 этой работе использован новый гальванографический метод, позволивший выявить динамическую составляющую скорости растворения пассивного металла, характеризующую количество и анодную активность дефектных мест пассивирующей пленки. [23]
С этой точки зрения, нужно ожидать, что адсорбционные слои, имеющие свойства двухмерного газа, не должны существенно замедлять растворение металла. Твердые, поверхностно-кристаллические адсорбционные слои ( двухмерные кристаллы) должны оказывать различное действие, в зависимости от характера связей в слое. Если при неполном заполнении поверхности атомы адсорбированного вещества прочно связываются между собой в плотные поверхностно-кристаллические островки, но не очень прочно связываются с металлом, то защитное действие таких слоев должно носить характер экранирования части поверхности. Надо отметить, что поверхностные, как и объемные, кристаллические структуры не бывают без дефектов. Последние создают локальные изменения энергетического состояния поверхности, что осложняет ожидаемые закономерности. В частности, в таких местах возможно ускоренное проникновение атомов или ионов металла через пассивирующий слой к раствору, что может изменять механизм растворения пассивного металла [275] или приводить к постепенному изменению величины и состояния поверхности. Пассивирующими являются, по-видимому, адсорбционные слои, имеющие сравнительно мало дефектов. [24]
Дефекты в кристаллах различаются по типу и происхождению. Значительная их часть ( фазовые неоднородности, включения, дефекты упаковки, дислокации) возникают уже в процессе изготовления слитков. Последующая глубокая пластическая деформация, неизбежная при производстве сортового металла, дополнительно порождает дефекты, прежде всего дислокации. В дефектных местах кристаллической поверхности имеют место значительные флуктуации термодинамических свойств решетки и энергии активации электрохимических процессов. Другим источником энергетической, а следовательно, и кинетической неоднородности, несомненно, являются дефекты пассивирующей пленки. Ясно, что этот фактор тесно связан с дефектами самого металла. Поэтому скорости растворения пассивного металла для разных микроучастков поверхности должны существенно отличаться друг от друга и изменяться с течением времени. Последнее обстоятельство отражает динамику как выхода внутренних дефектов решетки на поверхность растворяющегося кристалла, так и процессов нленкообразования. [25]
Страницы: 1 2