Растворение - натрий
Cтраница 1
Растворение натрия производится в сухом жидком аммиаке. [1]
После растворения натрия спиртовой раствор охлаждают, подкисляют азотной кислотой и определяют хлорид-ион титрованием по Фольгарду. Для определения хлора, находящегося в боковой цепи ароматического соединения ( например, в хлористом бензиле), пробу вещества нагревают г. о спиртовым раствором нитрата серебра, при этом хлор отщепляется, образуется осадок хлорида серебра, который отфильтровывают и взвешивают. [2]
После растворения натрия через раствор пропускают в течение приблизительно 1 5 мин воздух для образования катализатора, который должен способствовать быстрому превращению металлического натрия в амид. Затем добавляют в несколько приемов все необходимое количество металлического натрия ( всего 1 17 моль, или приблизительно 27 г) при непрерывном перемешивании. Реакция протекает интенсивно, с выделением водорода. [3]
После растворения натрия к охлаждаемой реакционной массе добавляют 25 мл диметплсульфоксида и 34 г ( 0 2 моль) фтортринитрометана ( см. с. Смесь перемешивают при комнатной температуре з течение 5 ч, затем фильтруют на стеклянном фильтре, фильтрат промывают охлажденной 20 % - ной H. [4]
После растворения натрия температуру бани доводят до 90 - 95, снова добавляют 2 г натриевой проволоки и медленно, по каплям, приливают 8 8 г уксусноэтилового эфира. Приблизительно через 20 - 30 минут содержимое колбы превращается в твердую пасту красного цвета, для растворения которой приливают 50 - 60 мл абсолютного бензола. [5]
После растворения натрия приливают 47 г фенола, растворенного в 40 мл спирта, и из капельной воронки, вставленной в отверстие форштосса - 60 г бромистого этила. [6]
После растворения натрия удаляют масляную баню, дают массе охладиться до 90, снабжают реакционную колбу капельной вороикой и при перемешиваний постепенно прибавляют 40 мл 50 -лого этилового спирта для растворения могущих остаться следов металлического натрия, а затем через капельную же воронку постепенно вводят 75 мл воды для разложения образовавшихся при реакции алкоголятов. Жидкость из колбы переносят в делительную воронку, дают отстояться выделившемуся маслянистому слою фенилэтилового спирта, после чего его отделяют, а водный слой тщательно экстрагируют эфиром. Эфирные вытяжки присоединяют к основной массе продукта и сушат над сплавленным сульфатом натрия. [7]
После растворения натрия добавляют 30 - 40 мл воды, количественно переносят раствор в мерную колбу емкостью 1 л, охлаждают до комнатной температуры, доливают до метки воду и перемешивают. Переносят пипеткой 25 мл Приготовленного раствора в коническую колбу емкостью 250 мл, приливают 25 мл воды, 2 - 3 капли метилового оранжевого и титруют соляной кислотой до перехода светло-желтой окраски раствора в светло-оранжевую. [8]
После растворения натрия добавляют 30 - 40 мл воды, количественно переносят раствор в мерную колбу емкостью 1 л, охлаждают до комнатной температуры, доливают до метки воду и перемешивают. Переносят пипеткой 25 мл йриготовленного раствора в коническую колбу емкостью 250 мл, приливают 25 мл воды, 2 - 3 капли метилового оранжевого и титруют соляной кислотой до перехода светло-желтой окраски раствора в светло-оранжевую. [9]
После растворения всего взятого натрия ( тщательно проверить. [10]
Скорость растворения натрия определяется анодным током, который соответствует смешанному потенциалу. Этот ток, называемый током коррозии, аналогичен току обмена при равновесном электродном потенциале. Механизм коррозии металла в газовой среде иногда усложняется прямым взаимодействием металла с кислородом. Катодный процесс при коррозии заключается в восстановлении ионов гид-роксония или кислорода. [11]
Скорость растворения натрия в электролите пропорциональна увеличению поверхности соприкосновения натрия с расплавом. Эта зависимость должна быть учтена при конструировании ванн. [12]
Скорость растворения натрия в электролите пропорциональна увеличению-поверхности соприкосновения натрия с расплавом. [13]
Скорость растворения натрия в электролите пропорциональна увеличению поверхности соприкосновения натрия с расплавом. [14]
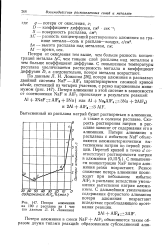 |
Потери на 100 г расплава ( по данным. [15] |
Страницы: 1 2 3 4