Растворение - окись - литий
Cтраница 1
Растворение окиси лития снижает количество ( Zn) междоузл, поэтому концентрация центров адсорбции кислорода с ростом содержания лития проходит через максимум. [1]
Растворение окиси лития в ZnO повышает энергию активации электропроводности и энергию активации реакции окисления. Таким образом, энергия активации электропроводности и окисления изменяются симбатно. [2]
 |
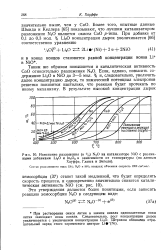
Зависимость скорости адсорбции кислорода от содержания растворенного L1 в решетке. [3] |
Растворение окиси лития в закиси никеля, как показано на рис. 1, влияет на объемные и поверхностные электрические свойства. [4]
 |
Изменение разложения ( в % N2O на катализаторе NiO с различными добавками Li2O и 1п2О3 в зависимости от температуры ( по данным Хауффе, Гланга и Энгеля. [5] |
При растворении окиси лития в закиси никеля одновалентные ионы лития замещают ионы никеля. [6]
При растворении окиси лития в ZnO энергия активации электропроводности растет, а уровень химического потенциала снижается; следовательно, при выполнении зависимости ( 1) растворение окиси лития должно было бы привести к снижению теплот и повышению энергий активации адсорбции кислорода и к обратной зависимости для адсорбции СО. На опыте адсорбция обоих газов изменяется в противоположном направлении. Расхождение указывает на невозможность объяснения полученных данных с этих позиций. Отметим, что изменение химической адсорбции газов - доноров и акцепторов электронов в противоположном направлении свидетельствует об электронном происхождении причин, вызывающих это изменение. [7]
Наиболее надежным путем определения теплоты образования кристаллической окиси лития является измерение теплот растворения окиси лития и металлического лития в воде. Теплота растворения лития в воде обсуждается в разделе по выбору теплоты образования кристаллической гидроокиси лития ( см. стр. [8]
Перхлорат лития LiC104 получается при взаимодействии карбоната лития с хлорной кислотой, растворением окиси лития в хлорной кислоте или действием хлорной кислоты на хлорид лития. Следы железа или пыль вызывают каталитическое разложение соли на воздухе. [9]
Исследование температурной зависимости адсорбции показало, что рост скорости адсорбции кислорода при растворении окиси лития в NiO и ZnO вызван снижением энергии активации Е адс и более медленным ростом ее при увеличении степени заполнения поверхности. Снижение же скорости адсорбции кислорода при растворении окиси железа в NiO связано с более крутым ростом Яадс при увеличении степени заполнения поверхности. Уровень Ферми при растворении Li2O в NiO и ZiO снижается. Это должно было бы привести к снижению теплот адсорбции газов акцепторов и повышению теплот адсорбции газов - доноров электронов. Изменение Яадс должно было быть обратным. Экспериментально найдено противоположное влияние растворения Li2O на адсорбцию. [10]
При растворении окиси лития в ZnO энергия активации электропроводности растет, а уровень химического потенциала снижается; следовательно, при выполнении зависимости ( 1) растворение окиси лития должно было бы привести к снижению теплот и повышению энергий активации адсорбции кислорода и к обратной зависимости для адсорбции СО. На опыте адсорбция обоих газов изменяется в противоположном направлении. Расхождение указывает на невозможность объяснения полученных данных с этих позиций. Отметим, что изменение химической адсорбции газов - доноров и акцепторов электронов в противоположном направлении свидетельствует об электронном происхождении причин, вызывающих это изменение. [11]
Растворение окиси лития в количеству 0 2 - 0 5 ат %, соответствующее содержанию одного иона Li на 200 ионов Ni2 или Zn2, оказывает очень сильное влияние на химическую адсорбцию. [12]
Было установлено, что растворение окиси лития снижает абсолютную величину электропроводности и увеличивает ее энергию активации. [13]
Было обнаружено, что введение лития повышает энергию активации окисления СО в пределах от 14 ккал / моль на ZnO без добавок до 40 ккал / моль для образца, содержащего 1 25 % Li. Как отмечалось ранее, растворение окиси лития в окиси цинка повышает энергию активации электропроводности. Таким образом, энергия активации электропроводности и энергия активации окисления СО изменяются симбатно. Сопоставление изменения адсорбции компонентов реакции и скорости каталитического окисления при растворении окиси лития приводит к заключению, что скорость каталитического процесса не может определяться ни адсорбцией кислорода, ни адсорбцией окиси углерода, так как первая при содержании 0 5 ат % Li сильно растет, а вторая отсутствует. Скорость же каталитической реакции на этом образце примерно такая же, как на ZnO без добавок. Нами было проверено, не оказывает ли влияние адсорбированный кислород на скорость адсорбции СО. С этой целью на ZnO с 0 5 % Li был адсорбирован при 300 кислород, затем при той же температуре впущен СО. В отсутствие кислорода СО не реагирует и не адсорбируется на этом образце. В присутствии адсорбированного кислорода происходит быстрый процесс поглощения СО с образованием СО2 и частичной адсорбцией СО. Сумма адсорбированной и поглощенной окиси углерода с образованием СО2 приблизительно равна количеству адсорбированного кислорода. Из этого опыта следует, что адсорбированный кислород оказывает влияние на скорость окисления СО. [14]
Возможны различные пути для объяснения этих данных. Общность результатов с полученными для влияния на химическую адсорбцию растворения окиси лития в закиси никеля [4] позволяет считать наиболее вероятным следующее: адсорбция кислорода происходит не на любых свободных электронах, а на электронах вблизи акцепторных дефектов, захвативших электроны. При растворении окиси лития в ZnO образуется твердый раствор замещения, в котором часть катионных узлов Zn 2 занята однозарядными катионами лития. Пониженный заряд примесных катионов компенсируется присутствием в междоузлиях катионов п) междоузл - Сочетание катионов Li ( Zn) междоузл является акцепторным центром. Проводимость ZnO, не содержащей посторонних химических примесей, связана с присутствием избыточного цинка, расположенного в междоузлиях и легко ионизирующегося с отдачей электронов в зону проводимости. При растворении окиси лития часть избыточного цинка расходуется на образование акцепторных центров. Электропроводность и в этом случае обеспечивается присутствием донор-ной примеси - избыточного цинка, электроны с которого будут распределены между зоной проводимости, донорными и акцепторными уровнями. [15]
Страницы: 1 2