Растворение - олово
Cтраница 3
Цинк и хром растворяют в содяной кислоте любой концентрации, для растворения олова требуется крепкая соляная кислота с подогревом. Кадмий и свинец растворяют в азотной кислоте. Сплавы титана травят в серной или соляной кислотах с добавками плавиковой кислоты. [31]
Рекомендуется через несколько часов работы менять местами аноды и катоды для растворения ранее осажденного олова. Указанный способ отличается простотой, однако он более длителен, чем приведенный выше, и связан с некоторыми потерями олова. [32]
Результаты сравнения могут вызвать сомнения в утверждении о диффузионном режиме процесса растворения олова и требуют специального объяснения. [33]
За некоторым исключением, катодная защита стали от коррозии в результате растворения олова [10-12] снижает для нелакированных оловянных покрытий риск перфорации или препятствует образованию заметных количеств железа. Основная опасность при этом - чрезмерная скорость растворения олова, которая приводит к ухудшению внешнего вида емкости, к изменению состояния продуктов, а также может ухудшать товарный вид из-за образования водородных пузырей. Водород, который накапливается в сосуде, раздувает его, при этом рост таких вздутий приблизительно пропорционален количеству растворенного железа. [34]
Хлорид олова SnCl2 - 2H2O получают в виде белых кристаллов при растворении олова в соляной кислоте. Он легко растворяется в воде, спирте и эфире. При электронографическом исследовании молекул SnQ2 ( а также SnBr2 и SnI2) в газообразном состоянии было установлено, что они имеют угловую структуру. [35]
Исходя из диффузионного характера процесса растворения, нетрудно понять и рост скорости растворения олова с увеличением концентрации растворителя. [36]
В начале процесса электролит содержит практически лишь NaOH, иа аноде идет процесс растворения олова, а на катоде выделение водорода. Когда концентрация Sn в растворе станет настолько значительной, что потенциал его выделения достигнет потенциала выделения водорода, последнее постепенно уступает место осаждению олова. После растворения всего олова на аноде начинается выделение кислорода. По мере работы раствор постепенно поглощает из воздуха углекислый газ. Большое содержание Na2CO3 ( свыше 25 - 30 г / л) снижает растворимость стан-ната и способствует его гидролизу с образованием на аноде корки SnO2, приводящей к его пассивированию. Поэтому часть раствора отбирают на регенерацию, при которой накопившийся Na2CO3 вновь каустифицирует с помощью извести. [37]
В начале процесса электролит содержит практически лишь NaOH, на аноде идет процесс растворения олова, а на катоде выделение водорода. Когда концентрация Sn в растворе станет настолько значительной, что потенциал его выделения достигнет потенциала выделения водорода, последнее постепенно уступает место осаждению олова. После растворения всего олова на аноде начинается выделение кислорода. По мере работы раствор постепенно поглощает из воздуха углекислый газ. Большое содержание Na2CO3 ( свыше 25 - 30 г / л) снижает растворимость стан-ната и способствует его гидролизу с образованием на аноде корки SnO2, приводящей к его пассивированию. Поэтому часть раствора отбирают на регенерацию, при которой накопившийся Na2COs вновь каустифицирует с помощью извести. [38]
В начале процесса электролит содержит практически лишь NaOH, на аноде идет процесс растворения олова, а на катоде выделение водорода. Когда концентрация Sn в растворе станет настолько значительной, что потенциал его выделения достигнет потенциала выделения водорода, последнее постепенно уступает место осаждению олова. [39]
Хлористое о л о-в о SnCl2 - 2H2O, или оловянная соль получается растворением олова в соляной к-те, употребляется как протрава гл обр. [40]
Из нитроароматических соединений рекомендуют [54] нитро-бензойную кислоту и ее соли, в присутствии которых растворение олова в щелочи значительно ускоряется. [41]
В ЧССР запатентован [67] способ, обеспечивающий стабильность пассивной пленки на анодах для предупреждения растворения олова в виде двухвалентных ионов. С этой целью в электролит вводят добавки, увеличивающие вязкость раствор а, например желатин, агар-агар, гуммиарабик, крахмал или гликоген, а также фенол, крезол, нафтол, пирокатехин и другие соединения, имеющие поверхностно-активные свойства. [42]
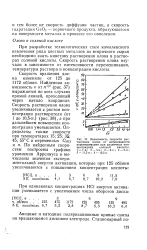 |
Зависимость скорости растворения олова от интенсивности перемешивания при различных концентрациях соляной кислоты. / - 1 - н.. 2 - 3 - н.. 3 - 6 - н.. 4 - 9 - н.. 5 - 11 5 - н.. 6 - 10 5 - н. [43] |
При разработке технологических схем комплексного извлечения ряда цветных металлов из вторичного сырья необходимо знать кинетику растворения олова в растворах соляной кислоты. [44]
Галогениды двухвалентного олова получают нагреванием олова в токе галогеноводорода или осторожным обезвоживанием кристаллогидратов 5пГ2, полученных растворением олова в соответствующих га-логеноводородных кислотах. [45]
Страницы: 1 2 3 4