Растворение - платина
Cтраница 2
Соотношение скоростей растворения платины и выделения кислорода остается постоянным и не зависит от потенциала электрода, природы аниона и протекающих одновременно на аноде других процессов. Это позволяет предположить, что оба рассматриваемых процесса имеют общие электрохимические стадии, определяющие скорость их протекания. Поскольку анодные реакции выделения кислорода ( так же как и озона) при потенциалах выше 1 5 В протекают с участием поверхностных окислов платины [64-67], вероятно предположение, что и анодное растворение платины также должно протекать через стадию образования промежуточного окисла. [16]
Наиболее общепринятый метод растворения платины и палладия, неэффективный для других платиновых металлов, - обработка царской водкой. Однако присутствие азотной кислоты мешает большинству классических и инструментальных методов анализа. Обработка соляной кислотой для удаления окислов азота приводит к образованию различных комплексных хлоридов, в виде которых осмий и рутений нельзя окислить и отогнать. [17]
Хлороплатинаг аммония получали растворением платины высокой чистоты ( 99 999 %) в царской водке, упариванием с соляной кислотой для удаления избытка азотной кислоты и осаждением хлоридом аммония. К хлороплатинату аммония в полипропиленовой бутыли при 100 добавляют рассчитанные количества растворов определяемых элементов и после высушивания перемешивают механически, встряхивая бутыль в смесителе. Затем все переносят во вращающуюся мельницу, где растирают не менее 72 час. [18]
Указанные металлы заметно замедляют растворение платины, а 30 % - ный сплав иридия с платиной, например, практически нерастворим в царской водке. [19]
Для сравнения характера и кинетики растворения платины при электролизе монокарбоновых кислот и моноэфиров дикарбоновых кислот проведено изучение влияния потенциала на скорость износа Pt в растворе ацетат натрия уксусная кислота вода при 30 С. Платиновый анод в виде плоской лопатки ( 5 7 5 см2) устанавливали в объемный зажим из нержавеющей стали, жестко закрепленный на крышке ячейки с помощью молибденового стержня. [20]
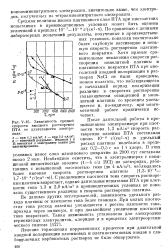 |
Зависимость средней скорости анодного растворения ПТА от длительности электролиза. [21] |
Хотя прямые сравнительные испытания скорости растворения монолитной платины и платинового покрытия ПТА при многолетней анодной поляризации в растворах NaCl не были проведены, можно полагать, что наблюдающееся в начальный период поляризации различие в скоростях растворения гальванически осажденной и монолитной платины со временем уменьшается и, по-видимому, при многомесячной работе практически исчезает. [22]
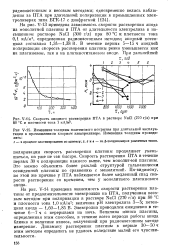 |
Скорость анодного растворения ПТА в растворе NaCl ( 270 г / л при 80 С и плотности тока 1 кА / м3. [23] |
На рис. V-14 приведена зависимость скорости растворения платины от продолжительности электролиза на ПТА, полученная весовым методом при поляризации в растворе NaCl ( 270 г / л) при 80 С и плотности тока 1 0 кА / м2; величина рН электролита 3 - 5; потенциал анода - 1 60 - 1 85 В. Электролиз проводился ежедневно в течение 6 - 7 ч с перерывами на ночь. Величина износа платины, определенная этим способом, в течение всего периода работы анода близка к величине износа, полученной при радиоизотопном методе измерения. Динамику растворения платины в первые 30 - 50 ч этим методом определить не удалось вследствие малой его чувствительности. [24]
Хлоротатиновая кислота, образующаяся в процессе растворения платины в царской водке, применяется в производстве катализаторов. Гексахлороплатинат калия применяется в фотопромышленности, тетрахлорид платины используется как катализатор в химической промышленности. [25]
 |
Влияние потенциала на скорость. [26] |
При увеличении концентрации НС1 плотность тока растворения платины и доля тока, расходуемого на ее растворение, снижаются, особенно сильно при введении первых порций НС1 в электролит. Поэтому при выборе условий электрохимического производства хлорной кислоты целесообразно применять верхний предел концентрации НС1, при котором еще не наблюдается существенного снижения выхода хлорной кислоты по току. [27]
 |
Электролизер для получения пероксобората натрия. [28] |
Исследовано также влияние добавок на скорость растворения платины в ходе электролиза раствора указанного ранее состава. Как в отсутствие добавки, так и в присутствии 0 2 г / л бихромата натрия расходуется 2 - 2 5 г платины на 1 т гидрата пероксогидрата метабората натрия. [29]
 |
Влияние потенциала на скорость. [30] |
Страницы: 1 2 3 4