Растворение - безводная соль
Cтраница 1
Растворение безводной соли, способной давать кристаллогидраты, протекает в две стадии: а) гидратации и б) растворение гидрата. [1]
Теплота растворения безводной соли MgSO-i равна 20300 кал / моль, г кристаллогидрата MgSO4 - 7H2O - равна 3800 кал / моль. Чему равна теплота гидратации. [2]
При растворении безводных солей, например га-лита, гидратные оболочки их ионов сжимаются и суммарный объем системы соль вода уменьшается. Если же порода включает кристаллогидраты ( например, бишофит или карналлит), при растворении последних объем системы кристаллогидрат 4 - вода увеличивается. С ростом температуры увеличение объема становится еще более значительным. Некоторые исследователи полагают поэтому, что в тех случаях, когда возможны подобные фазовые переходы, давление в каверне может оказаться даже существенно больше горного. [3]
Если теплота растворения безводной соли положительна, то поправку следует прибавлять, а если отрицательна - вычитать из величины температурной депрессии, полученной по правилу Бабо. [4]
Если теплота растворения безводной соли положительна, то поправку следует прибавлять, а если отрицательна-вычитать из величины температурной депрессии, полученной по правилу Бабо. [5]
Калориметрическое изучение растворения безводной соли аналогично изучению растворения кристаллогидрата. Учитывая гигроскопичность безводной соли, максимально ограничивают время контакта соли с атмосферой. [6]
Найти интегральную теплоту растворения безводной соли CuSO4 при 20 С, если интегральная теплота растворения кристаллогидрата CuSO4 - 5H2O при данной температуре равна - 11 94 кдж / моль, а теплота гидратации безводной соли при переходе ее в кристаллогидрат составляет 78 50 кдж / моль. [7]
Рассчитать интегральную теплоту растворения безводной соли CuSO4 при 20 С, если интегральная тепло-га растворения кристаллогидрата CuSCVeb O при данной температуре равна - 11 94 кдж / моль, а теплота гидратации безводной соли при переходе ее в кристаллогидрат 78 50 кдж / моль. [8]
Измеряют интегральные теплоты растворения безводной соли и кристаллогидрата и вычисляют теплоту образования кристаллогидрата по закону Гесса ( стр. [9]
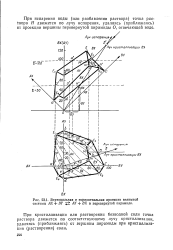 |
Вертикальная и горизонтальная проекции взаимной системы АХ BY AY ВХ в перевернутой пирамиде. [10] |
При кристаллизации или растворении безводной соли точка раствора движется по соответствующему лучу кристаллизации, удаляясь ( приближаясь) от вершины пирамиды при кристаллизации ( растворении) соли. [11]
Изменение абсолютных значений тепловых эффектов растворения безводных солей и их кристаллогидратов в воде, прошедшей магнитную обработку, по сравнению с аналогичными тепловыми эффектами растворения в необработанной воде обусловлено изменением гидратации ионов под воздействием внешнего магнитного поля. А изменение ( уменьшение) гидратации ионов создает условия для образования ионных ассоцнатов. [12]
Вычисляют тепловое значение калориметра, энтальпии растворения безводной соли и кристаллогидрата и энтальпию образования кристаллогидрата из безводной соли и воды. Результаты эксперимента записывают в протокол. [13]
Теплоту гидратации определяют из интегральных теплот растворения безводной соли и кристаллогидрата в таких количествах воды, чтобы полученный раствор в обоих случаях имел одинаковую концентрацию. [14]
Эта работа сводится к измерению интегральных теплот растворения безводной соли и кристаллогидрата и к последующему вычислению теплоты гидратообразования по закону Гесса ( стр. [15]
Страницы: 1 2 3 4