Растворение - безводная соль
Cтраница 2
Теплота гидратации соли определяется по разности теп-лот растворения безводной соли и ее кристаллогидрата. [16]
Определение теплоты гидратообразования сводится к определению теплот растворения безводной соли и ее кристаллогидрата. Берут две навески по 7 5 г растертого в порошок кристаллогидрата. Первую навеску используют для определения теплоты растворения кристаллогидрата, а вторую переносят в фарфоровую чашку и нагревают на горелке до тех пор, пока не получится порошок безводной соли. Пересыпают ее в предварительно взвешенную пробирку, которую сейчас же закрывают резиновой пробкой, и после остывания пробирку взвешивают. Производят определение теплоты растворения безводной соли в 300 г, а кристаллогидрата в 297 г воды. [17]
Теплота гидратации соли определяется по разности теплот растворения безводной соли и ее кристаллогидрата. [18]
Экспериментально определить теплоту гидратации можно только при растворении безводной соли в воде. [19]
Им было отмечено образование синего раствора при растворении безводной соли кобальта в абсолютном этаноле. [20]
 |
Изменение тепловых эффектов растворения веществ в воде, подвергнутой магнитной обработке. [21] |
Анализ приведенных данных показывает, что тепловые эффекты растворения безводных солей в воде, прошедшей магнитную обработку, ниже, а тепловые эффекты растворения кристаллогидратов выше, чем соответствующие тепловые эффекты растворения солей в необработанной воде. [22]
Определение теплоты образования кристаллогидрата, которое сводится к определению теплот растворения безводной соли и ее кристаллогидрата. [23]
Здесь индекс О означает, что теплота растворения определяется при растворении безводной соли в относительно большом количестве воды. [24]
При растворении кристаллогидратов в воде наблюдается более низкий тепловой эффект, чем при растворении безводной соли. [25]
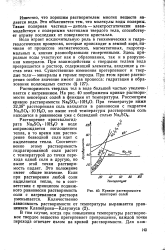 |
Кривые растворимости некоторых солей. [26] |
Растворение кристаллогидрата Na2SO4 10Н2О в воде сопровождается поглощением тепла, в то время как растворение безводной соли идет с выделением тепла. Соответственно этому растворимость гидратированной соли растет с температурой до точки перехода одной соли в другую, но выше этой точки растворимость падает. Это положение имеет общее значение. Если при растворении любой соли выделяется тепло, то в соответствии с принципом подвижного равновесия растворимость соли с нагреванием раствора уменьшается. [27]
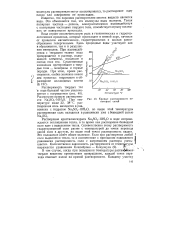 |
Кривые растворимости некоторых солей. [28] |
Растворение кристаллогидрата Na2SO4 10H2O в воде сопровождается поглощением тепла, в то время как растворение безводной соли идет с выделением тепла. Соответственно этому растворимость гидратированной соли растет с температурой до точки перехода одной соли в другую, но выше этой точки растворимость падает. Это положение имеет общее значение. Если при растворении любой соли выделяется тепло, то в соответствии с принципом подвижного 1 равновесия растворимость соли с нагреванием раствора умень - шается. [29]
При различных температурах могут также наблюдаться положительные и отрицательные разницы между коэффициентами скорости, растворения Ка безводной соли и ее кристаллогидратов ( например, у Na2SO4 и Na2SO4 10Н2О), что связано с аналогичным температурным изменением их растворимостей. [30]
Страницы: 1 2 3 4