Растворение - хлористый водород
Cтраница 1
Растворение хлористого водорода является физико-химическим процессом, при этом происходит взаимодействие хлористого водорода с водой, сопровождающееся выделением тепла. [1]
Растворение хлористого водорода в толуоле не вызывает сколько-нибудь значительного изменения в спектрах поглощения ароматического соединения. Более того, даже при - 78 51 легко устанавливается равновесие между этими тремя компонентами, если энергия активации образования комплекса очень мала. Эти растворы не обладают сколько-нибудь заметной проводимостью. [2]
Растворение хлористого водорода в воде сопровождается образованием гидратов и идет с выделением тепла. [3]
Растворением хлористого водорода в воде получают соляную кислоту. [4]
После растворения хлористого водорода в воде образуется соляная кислота, состав которой доказывается: а) по посинению красной бумажки конго и б) по образованию белого творожистого осадка при сливании ее с раствором азотнокислого серебра. [5]
 |
Зависимость растворимости HClor. [6] |
Теплота растворения хлористого водорода снижается в ряду растворителей: дихлорэтан трихлорэтан трихлорэтилен тетрахлорэтан. [7]
 |
Растворимость НС1 в воде при различных условиях. [8] |
Теплота растворения хлористого водорода в органических рас - йорителях составляет 3 - 4 ккал / моль. [9]
При растворении хлористого водорода в воде образуется хлористоводородная кислота. Концентрированная хлористоводородная кислота имеет уд. [10]
Как известно, растворение хлористого водорода в воде сопровождается довольно сильным разогреванием образующегося раствора. Действительно, энергия связи водорода и хлора в молекуле НС1 равна 1360 кДж / моль. Вот почему при образовании растрора соляной кислоты и происходит довольно сильное разогревание. [11]
Как известно, растворение хлористого водорода в воде сопряжено с довольно сильным разогреванием образующегося раствора. Действительно, энергия связи водорода и хлора в молекуле НС1 равна 1360 кДж / моль. Вот почему при образовании раствора соляной кислоты и происходит довольно сильное разогревание. [12]
Соляную кислоту получают растворением хлористого водорода в специальных поглотительных башнях. При этом вода подается сверху башни, а хлористый водород - снизу. [13]
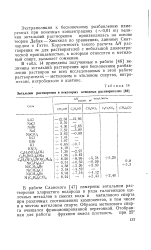 |
Энтальпии растворения в некоторых неводных растворителях. [14] |
В работе Сланского [47] измерены энтальпии растворения хлористого водорода и ряда галогенидов щелочных металлов в смесях воды и метилового спирта при различных соотношениях компонентов, в том числе и в чистом метиловом спирте. [15]
Страницы: 1 2 3 4