Растворение - гидроксид
Cтраница 2
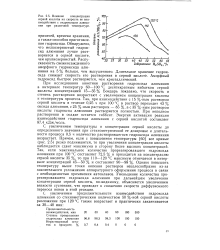 |
Влияние концентрации серной кислоты на скорость ее взаимодействия с гидроксидом алюминия при различной температуре. [16] |
При исследовании кинетики растворения гидроксида алюминия в интервале температур 60 - 100 С десятикратным избытком серной кислоты концентрацией 15 - 35 % Бондарь показано, что скорость и степень растворения возрастают с увеличением концентрации кислоты и температуры процесса. Так, при взаимодействии с 15 % - ным раствором серной кислоты в течение 0 25 ч при 100 С в раствор переходит 43 % оксида алюминия, с 25 % - ным раствором - 85 %, а с 35 % - ным раствором кислоты гидроксид алюминия растворяется полностью. При неполном растворении в осадке остается гиббсит. Энергия активации реакции взаимодействия гидроксида алюминия с серной кислотой составляет 87 4 кДж / моль. [17]
Получают безводную CuF2 растворением гидроксида или карбоната меди ( II) в плавиковой кислоте и последующим нагреванием в парах HF, а кристаллогидрат - из раствора в разбавленной плавиковой кислоте. [18]
Определение основано на растворении гидроксида и оксида стронция в хлороводородной кислоте с образованием хлорида стронция и последующем его анализе методом пламенной фотометрии по синей полосе спектра пламени стронция. [19]
Подобными же причинами обусловлено растворение амфотер-ных гидроксидов в растворах щелочей. [20]
При отсутствии азота после растворения гидроксидов железа синего пятна не образуется. [21]
Соли трехвалентного железа получаются растворением гидроксида железа ( III) в соответствующих кислотах. Все они обладают в большей или меньшей степени окислительными свойствами. [22]
Фторид алюминия A1F3 образуется при растворении гидроксида во фтористоводородной кислоте. С фторидами щелочных металлов образует комплексные соединения. [23]
В чем заключается различие между реакциями растворения гидроксида меди ( II) в щелочи и в растворе аммиака. [24]
Составьте молекулярные и ионные уравнение реакций растворения гидроксида хрома ( III) Сг ( ОН) з в растворах: H2SO4; NaOH. Сколько граммов Na [ Сг ( ОН) 4 ] образуется, если в реакцию вступает 32 г гидроксида натрия. [25]
Вследствие этого введение NH4C1 приводит к растворению гидроксида магния. [26]
Нами разработан метод получения гидроксохлорида алюминия растворением технического гидроксида алюминия в смеси соляной и серной кислот. В результате синтеза получается гелеобразный продукт белого цвета, что указывает на присутствие в нем кроме гидроксохлорида алюминия незначительного количества нерастворимых гидроксосульфатов алюминия. Как показали данные дериватографических исследований, наличие гидроксосульфатных примесей повышает температуру разложения связки с 290 до 420 С. [27]
 |
Пример результатов качественного анализа катионов и анионов в задаче. [28] |
Глюкоза и сахароза в щелочном растворе вызывают растворение гидроксида меди в результате образования комплекса, ио глюкоза в отличие от сахарозы восстанавливает ионы Си2 1, связанные в комплекс. Поэтому из темно-сииего раствора, содержащего комплекс меди и глюкозы, при нагревании осаждается кирпично Красиый оксид меди ( 1), а такой же раствор комплекса меди и сахарозы при нагревании не изменяется. [29]
Водные растворы щелочей применяются в основном для растворения гидроксидов алюминия, например гиббсита: Al ( OH) s NaOH - - Na [ А1 ( ОН) 4 ], а также для выявления внутреннего строения некоторых минералов, преимущественно силикатов. [30]
Страницы: 1 2 3 4