Анодное растворение - титан
Cтраница 2
Стандартный электродный потенциал титана составляет 1 21 в. Коррозия и анодное растворение титана даже в растворах серной и соляной кислот протекают лишь при - 0 45 в и более положительных значениях потенциала. Это свидетельствует об очень большом торможении процесса растворения титана. Увеличение продолжительности предварительной катодной поляризации от 1 до 18 ч ( кривая 3) приводит к увеличению максимального анодного тока. Это объясняется разрыхлением поверхности под влиянием наводороживания, увеличением истинной поверхности, о котором говорилось уже выше. [16]
Повышение коррозионной стойкости титана катодным легированием является перспективным направлением, так как этим способом удается небольшими добавками легирующего элемента значительно повысить коррозионную устойчивость титана. Третий легирующий компонент должен либо смещать потенциал полной пассивации титана в отрицательную сторону, либо значительно снижать ток анодного растворения титана вблизи потенциала полной пассивации, либо влиять на электрохимическое поведение титана по этим двум направлениям одновременно. Для достижения высокой коррозионной стойкости титана путем легирования термодинамически более стойким металлом или металлом, более легко пассивирующимся, необходимо введение значительного количества лег и р ующего компонента. [17]
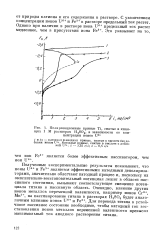 |
Поляризационные кривые Ti, снятые в кипящих 1 М растворах H2S04, в зависимости от концентрации ионов U6 1. [18] |
Полученные экспериментальные результаты показывают, что ионы U6 и Fe3 являются эффективными катодными деполяризаторами, значительно облегчают катодный процесс и, поскольку их окислительно-восстановительный потенциал лежит в области пассивного состояния, вызывают соответствующее смещение потенциала титана в пассивную область. Для перевода титана в устойчивое пассивное состояние необходимо, чтобы катодный ток восстановления ионов металлов переменной валентности превысил максимальный ток анодного растворения титана. [19]
Таким образом, результаты коррозионных испытаний согласуются с результатами электрохимических измерений. Благотворное влияние молибдена или хрома на повышение коррозионной стойкости сплавов титан-палладий объясняется тем, что оба эти элемента уменьшают ток анодного растворения титана вблизи его потенциала полной пассивации. В случае легирования хромом это достигается благодаря тому, что хром имеет более отрицательный потенциал полной пассивации, чем титан, а при легировании молибденом - главным образом за счет значительного снижения способности титана к анодному растворению. При дополнительном легировании сплавов титан-хром, титан-молибден палладием, обеспечивающим значительное смещение стационарного потенциала металла в положительную сторону, потенциал сплавов оказывается в области значений, где токи анодного растворения сплавов меньше, чем ток анодного растворения титана. [20]
При этом потенциале ток анодного растворсннл сплавов Ti - 15Мо и Ti - 15Сг вследствие смещения потенциала полной пассивации в отрицательную сторону по сравнению с его положением для нелегированного титана и сокращения петли анодного растворения значительно меньше, чем ток анодного растворения титана. [21]
Стационарные потенциалы сплавов Ti-15 % Mo - 2 % Pd, Ti - 15 % Сг - 2 % Pd и Ti - 2 % Pd, как видно из фиг. При этом потенциале ток анодного растворения сплавов Ti - 15 % Mo и Ti - 15 % Сг, вследствие смещения потенциала полной пассивации в отрицательную сторону по сравнению с положением его для титана, значительно меньше, чем ток анодного растворения титана. [22]
С этой точки зрения резкое снижение коррозии титана в расплаве под вакуумом объясняется резким снижением концентрации катодного деполяризатора ( кислорода) в расплаве. Коррозия в этом случае не исключается совершенно, а остается довольно высокой ( 14 г / м2 ч - 28 мм / год в КС1 при 850 С), хотя, если строго придерживаться механизма, развиваемого авторами [86], коррозия должна была бы снизиться до нуля. Коррозионный процесс анодного растворения титана в расплаве под вакуумом может сопровождаться катодной деполяризацией различными примесями, находящимися в расплаве, способными к восстановлению на катоде. [23]
В безводных уксуснокислых растворах титан не пассивируется. Анодные поляризационные кривые в широком интервале потенциалов подчиняются уравнению Тафеля с наклоном, близким к 2 3 RTJF. Выход по току при анодном растворении титана близок к 100 % при расчете на Ti ( III) в пределах участка поляризационной кривой ( ( 10 - 3 А / см2) или Ti ( IV) при более высоких потенциалах и плотностях тока. Анодное поведение сплавов на основе титана, но содержащих молибден, существенно отличается от поведения титана. [24]
В безводных уксуснокислых растворах титан не пассивируется. Анодные поляризационные кривые в широком интервале потенциалов подчиняются уравнению Тафеля с наклоном, близким к 2 3 RT / F. Выход по току при анодном растворении титана близок к 100 % при расчете на Ti ( III) в пределах участка поляризационной кривой ( ( 10 - 3 А / см2) или Ti ( IV) при более высоких потенциалах и плотностях тока. Анодное поведение сплавов на основе титана, но содержащих молибден, существенно отличается от поведения титана. [25]
Потенциалы даны по отношению к нормальному водородному электроду. Как видно из фигуры, анодное растворение титана в метиловом спирте, содержащем 0 1 и 2 % брома, происходит без заметного торможения. Наложение анодного тока почти не изменяет стационарного потенциала металла в этих средах. Только при очень больших плотностях тока потенциал титана несколько смещается в положительную сторону, причем это смещение более резко выражено в среде с меньшим содержанием брома. [26]
Если у металла или сплава потенциал пассивации более отрицательный, чем потенциал катодного процесса водородной деполяризации на сплаве с катодной добавкой, то вполне возможна пассивация сплава за счет водородной деполяризации. Из этих кривых видно, что перенапряжение водорода при введении в титан 1 % Pt снижается на 350 - 400 мв. Вследствие этого стационарный потенциал сплава титана с платиной смещается в положительную сторону, в область пассивных значений, где процесс анодного растворения титана сильно заторможен. Это обеспечивает высокую коррозионную стойкость сплава титана с платиной. [27]
Добавление воды в метиловый спирт, содержащий 2 % брома, вызывает возрастание анодной поляризуемости титана. В растворе, содержащем 30 % воды, анодная поляризуемость титана сильно возрастает. В этой среде при достижении высоких положительных потенциалов ( около 1 в), как и в чистом метиловом спирте, происходит местное анодное растворение титана вследствие активации анодной окисной пленки ионами брома. [28]
При потенциалах, более положительных, чем потенциал начала пассивации, скорость адсорбции кислорода уже превышает скорость обновления поверхности. Все большая часть поверхности титанового электрода покрывается хемосорбированным кислородом, вследствие чего сокращается активная поверхность металла и уменьшается плотность анодного тока. Епп, соответствующем минимуму плотности анодного тока, электрод полностью покрыт адсорбированным кислородом. Далее при потенциалах положительнее нуля в пассивной области анодное растворение титана идет с образованием четырехвалентных ионов титана, и для всех скоростей обновления поверхности наблюдается область независимости анодного тока от потенциала. [29]
Таким образом, результаты коррозионных испытаний согласуются с результатами электрохимических измерений. Благотворное влияние молибдена или хрома на повышение коррозионной стойкости сплавов титан-палладий объясняется тем, что оба эти элемента уменьшают ток анодного растворения титана вблизи его потенциала полной пассивации. В случае легирования хромом это достигается благодаря тому, что хром имеет более отрицательный потенциал полной пассивации, чем титан, а при легировании молибденом - главным образом за счет значительного снижения способности титана к анодному растворению. При дополнительном легировании сплавов титан-хром, титан-молибден палладием, обеспечивающим значительное смещение стационарного потенциала металла в положительную сторону, потенциал сплавов оказывается в области значений, где токи анодного растворения сплавов меньше, чем ток анодного растворения титана. [30]
Страницы: 1 2 3