Анодное растворение - цинк
Cтраница 1
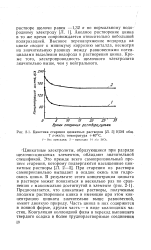 |
Кинетика старения цинкатных растворов [ Л. 5 ] КОН общ. 7 г-экв / л. температура 40 С. [1] |
Анодное растворение цинка в то же время сопровождается относительно небольшой поляризацией. Высокое перенапряжение водорода на цинке сводит к минимуму коррозию металла, несмотря на значительную разницу между равновесными потенциалами выделения водорода и растворения цинка. Кроме того, электропроводность щелочного электролита значительно выше, чем у нейтрального. [2]
Кривые анодного растворения цинка и кадмия из амальгам регистрируют так же, как при определении меди и свинца. Концентрацию цинка определяют по градуировочному графику, построенному в координатах: величина отношения глубин пиков цинка и кадмия - концентрация цинка. [3]
В работе рассматривается влияние ряда ПАВ на анодное растворение цинка и на катодное выделение металла и-з пирофос-фатного электролита. [4]
 |
Локальные токи при растворении цинка с включением из меди ( а и поляризационные кривые локального элемента ( б. [5] |
Потенциал цинка смещается в анодную сторону, что приводит к ускорению анодного растворения цинка и уменьшению скорости выделения водорода на цинке. В то же время на поверхности включения происходит интенсивное выделение водорода. Кривая / характеризует анодное растворение основного металла, кривая 2 - выделение водорода на этом металле. Поэтому фактически коррозионный процесс зависит от скорости анодного растворения металла и выделения водорода на включении. Реакции, которым отвечают кривые / и 3, протекают на разных по размеру участках поверхности. Так как суммарная сила катодного тока должна равняться суммарной силе анодного тока, плотности катодного и анодного токов не равны. Величина / х характеризует максимальный ток локального элемента. [6]
Потенциал цинка смещается в анодную сторону, что приводит к ускорению анодного растворения цинка и уменьшению скорости выделения водорода на цинке. В то же время на поверхности включения происходит интенсивное выделе-ние водорода. [7]
Если к такой системе подключить такой сильный катод, как платина, то заметно ослабляется катодная эффективность других электродов и усиливается анодное растворение цинка. [8]
 |
Сосуд для электролиза с диафрагмой. [9] |
Губка возникает, как правило, после добавления к чистому электролиту цинковой пыли или порошка из губки, а также при приготовлении электролита анодным растворением цинка в щелочи и при электролизе с цинковыми анодами независимо от степени чистоты ( исключая примеси Sn, Pb и Hg) анодов и электролита. [10]
Принимая, что вклад последнего процесса не зависит от NCU и NZn и составляет 1 10 - 9 м [109], была оценена реальная толщина обогащенной зоны, образовавшейся только за счет селектив: но го анодного растворения цинка ( кр. При малых плотностях анодного тока толщина зоны приблизительно обратно пропорциональна скорости растворения - сплава в полном соответствии с моделью объемной диффузии. Однако при i4 - 10 - 5 А / см2 величина 8 стабилизируется на уровне порядка 0 3 - 10 - 9 м ( 1 - 2 атомных монослоя) г и в дальнейшем уже не зависит от интенсивности растворения. [11]
Например, если покрыть сталь цинком, то в случае коррозии цинк, как более электроотрицательный металл ( нормальный потенциал - 0 76 в), начнет постепенно разрушаться и сталь ( нормальный потенциал-0 44 в) благодаря анодному растворению цинка не будет корродировать. [12]
Из табл. 32 следует, что электрохимическая природа покрытий из меди и цинка на стали прямо противоположна: цинковые покрытия анодны и электрохимически защищают сталь, медные покрытия катодны и ускоряют коррозию стали в порах покрытия. Анодное растворение более отрицательного цинка приводит к значительной катодной поляризации в порах, так что их наличие сказывается только на скорости растворения цинка. Потенциалы цинкового покрытия на стали близки к потенциалам цинкового конденсата. Отличие в 100 мВ обусловлено пористостью покрытий. [13]
Реакция восстановления ионов Сг2О7 - на угольном электроде протекает очень легко и с большой скоростью. Без особых затруднений идет и анодное растворение цинка. В результате этого элементы такого типа могут быть разряжены высокими плотностями тока без существенной поляризации электродов и связанного с этим снижением разрядного напряжения. [14]
Характер влияния концентрации соли на величину энергии активации при катодном выделении цинка аналогичен наблюдаемому при анодном растворении кадмия. Подобная же аналогия имеет место у анодного растворения цинка и катодного выделения кадмия. Указанная аналогия сочетается с зеркальным различием згказанных зависимостей. [15]
Страницы: 1 2