Растворимость - магний
Cтраница 3
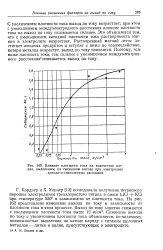 |
Влияние плотности тока на количество натрия, выделенное - на свинцовом катоде при электролизе криолито-глиноземных расплавов. [31] |
С увеличением плотности тока выход по току возрастает; при этом с уменьшением междуэлектродного расстояния влияние плотности тока на выход по току сказывается сильнее. Это объясняется тем, что с уменьшением катодной плотности тока растворимость магния в электролите возрастает. [32]
При электролитическом получении магния в современной практике применяют трехкомпонентные и более сложные электролиты, содержащие, кроме хлорида магния, добавки хлоридов калия, натрия и кальция. Кроме повышения электропроводности, в таких расплавах под влиянием КС1 и NaCl снижается растворимость магния ( гл. VIII), что должно было бы положительно влиять на выход по току. Подтверждение подобной закономерности наглядно видно на примере электролитического получения свинца в расплаве РЬС12 КС1: добавка хлорида калия понизила растворимость свинца в расплаве и способствовала повышению выхода по току. [33]
АМгб-Т примесей ванадия и титана приводит к образованию интерметаллических включений в структуре, действующих как острые надрезы. Они ухудшают коррозионную стойкость и декоративный вид материала. При комнатных температурах растворимость магния в алюминии уменьшается до 2 %, но распад твердого раствора протекает крайне медленно. Поэтому такие сплавы почти не разупрочняются при сварке и коэффициент ослабления сваркой близок к единице. [34]
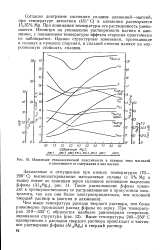 |
Изменение технологической пластичности в сплавах типа магналий в зависимости от содержания в них магния. [35] |
Согласно диаграмме состояния сплавов алюминий-магний, при температуре эвтектики ( 451 С) в алюминии растворяется 15 35 % Mg. При понижении температуры эта растворимость уменьшается. Несмотря на уменьшение растворимости магния в алюминии, с понижением температуры эффекта старения практически не наблюдается. Однако структурные изменения, протекающие в сплавах в процессе старения, в сильной степени влияют на коррозионную стойкость сплавов. [36]
Алюминий может содержать более 17 % магния в твердом растворе. На рис. 77 показана однородная область существования фазы а на диаграмме состояния системы Al-Mg. Несмотря на то что растворимость магния в алюминии достаточно высока, на сплавах системы А1 - Mg до 9 % Mg не наблюдается ощутимого эффекта упрочнения за счет распада твердого раствора в процессе старения при температуре ниже линии растворимости. [38]
Рассматривая механизм потерь металла в процессе электролиза, П. П. Федотьев указывал на то, чтЧ выделяющийся на катоде металл, растворяясь в электролите, поступает к ано-ду и здесь потребляется, взаимодействуя с анодными продуктами. При данной поверхности катода количество выделяющегося на нем в единицу времени металла пропорционально плотности тока. Потери же выделившегося металла, обусловленные растворимостью магния и ( поступлением электролита, насыщенного металлом, к аноду, не зависят от плотности тока и почти постоянны. Следовательно, с повышением плотности тока на катоде выход по току должен возрастать. Но при значительном увеличении плотности тока возрастает напряжение и повышается расход энергии. Практически при электролитическом получении магния изменение плотности тока от 0 3 до 0 7 а / см2 мало сказывается на выходе по току при расстояниях между анодом и катодом более 6 см. При меньших межполюсных расстояниях возрастание выхода по току с увеличением плотности тока более резко выражено, хотя в этих случаях абсолютные значения выхода по току несколько снижаются. [39]
Как магний, так и хлор практически не взаимодействуют с электролитом. Но магний незначительно растворяется в электролите - до 0 02 - 0 - 3 % ( вес. Добавка хлористого кальция к электролиту несколько снижает растворимость магния. Растворимость хлора в расплаве незначительна. С повышением температуры растворимость магния в электролите возрастает. [40]
Производные о д н о в а л ен тн ы х бериллия и магния не получены. В качестве промежуточных продуктов ионы Ве и Mg образуются, по-видимому, при анодном окислении этих металлов. Mg я 2MgCl связана, вероятно, частичная ( порядка одного атома на 100 молекул) растворимость магния в расплаве его хлорида. [41]
Однако такие низкие температуры даже вредны для процесса электролиза, так как не позволят получать магний в жидком состоянии, который мог бы всплывать. Добавки хлоридов калия и натрия понижают гидролиз MgCl2 и уменьшают вязкость электролита. При снижении концентрации MgCl2 в электролите выход по току повышается, так как уменьшается растворимость магния в электролите, но снижение MgCl2 приводит к уменьшению плотности электролита. [42]
Как магний, так и хлор практически не взаимодействуют с электролитом. Но магний незначительно растворяется в электролите - до 0 02 - 0 - 3 % ( вес. Добавка хлористого кальция к электролиту несколько снижает растворимость магния. Растворимость хлора в расплаве незначительна. С повышением температуры растворимость магния в электролите возрастает. [43]
Страницы: 1 2 3