Растворимость - металл
Cтраница 1
 |
Удельные веса ацетальдегида. [1] |
Растворимость металлов в кислотах как процесс разрушения поверхности металла под влиянием среды также принято называть коррозией. В этом случае коррозия чаще всего выражается в г / м - час. [2]
Растворимость металла в расплаве увеличивается с температурой и иногда достигает весьма больших значений. Взаимодействие продуктов электролиза между собой и с электролитом зависит от плотности тока на катоде. [3]
Растворимость металлов в расплавах других металлов колеблется в широких пределах. Так, серебро отлично растворимо в цинке и очень мало в свинце, цинк малорастворим в жидком свинце. [4]
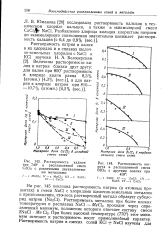 |
Растворимость висмута в расплавленной смеси Bids с другими солями при 450. [5] |
Растворимость металлов при более низких температурах в расплавах NaCl - МеС12 проходит через определенный минимум, положение которого отвечает составу смеси 2NaCl Me СЬ - При более высокой температуре ( 770) этот минимум исчезает и растворимость носит прямолинейный характер. [6]
 |
Фазовая диаграмма9 системы Bi-BiCL. [7] |
Растворимость металла в системах Zn - ZnF2 31 составляет лишь - 1 мол. По аналогии с кадмиевыми системами столь низкую растворимость можно объяснить отсутствием свободных ионов Zn2 в расплавленном ZnCl2 - Вероятно, цинк в растворе присутствует в форме комплексных ионов. [8]
Растворимость металлов друг в друге в твердом состоянии в работе [1] не исследовали. Построенная в этой работе диаграмма состояния была подтверждена в работе [2], выполненной методами термического и микроструктурного анализов и измерением электросопротивления и его температурного коэффициента. В этой работе температуры перитектической и эвтектической реакций были определены в 455 и 35 Г соответственно. [9]
Растворимость металлов понижается при наличии солевых добавок и комплексообразования в расплаве [4, 9], с ростом межфазного натяжения [4, 9], с увеличением радиуса аниона и поляризации [4], при наличии некоторых примесей других металлов. Положение равновесия и величина константы обменной реакции ( VI-1) зависят от температуры и разбавления металлической и солевой фаз. [10]
Растворимость металлов в солевых расплавах играет большую роль в процессах их электролиза. По-видимому, она является главной причиной отклонений от законов Фарадея, наблюдаемых при электролизе солевых расплавов. [11]
Растворимость металлов в расплавленной соли уменьшается при введении в расплав соли другого, более электроотрицательного металла. Растворимость, например, Cd в CdCl2 уменьшается при добавлении в расплавленный CdCl2 солей КС1, СаС12 и др. Растворимость металла меняется при разбавлении металлической фазы более электроположительным металлом. [12]
Растворимость металла в расплаве увеличивается с температурой и иногда достигает весьма больших значений. [13]
Растворимость металла Б в Л ограничена и изменяется с изменением температуры по линии а-в. Для эвтектической температуры растворимость максимальна и определяется проекцией точки а на горизонтальную ось, а для нормальной температуры определяется концентрацией, соответствующей точке в. Растворимость А в Б также ограничена ( линия б-г), но от температуры в рассматриваемом случае не зависит. [14]
Растворимость металлов в чистых солях обычно выше, чем в смесях солей, в особенности с резко различной природой катионов. [15]
Страницы: 1 2 3 4