Растворимость - металл
Cтраница 2
Растворимость металла невелика: 0 02; 0 052 и 0 123 % ( мол. Понятно, что столь незначительные концентрации субхлоридов свинца не влияют на вязкость и электропроводность расплавов. [16]
Растворимость металлов в чистых солях обычно выше, чем в смесях солей, особенно с резко различной природой катионов. [17]
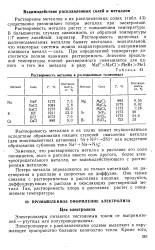 |
Растворимость металлов в расплавленных галогенидах. [18] |
Растворимость металла растет с повышением температуры. В большинстве случаев зависимость от обратной температуры 1 / Г имеет линейный характер. Растворимость щелочных и щелочноземельных металлов бывает настолько значительной, что некоторые системы можно охарактеризовать диаграммами плавкости металл - соль. При определенной температуре достигается полная взаимная растворимость. [19]
Растворимость металлов увеличивается с ростом температуры ( рнс. [20]
Растворимость металла в расплаве увеличивается с температурой и иногда достигает весьма больших значений. Взаимодействие продуктов электролиза между собой и с электролитом зависит от плотности тока на катоде. [21]
Растворимость металлов в ртути весьма различна. Наибольшей растворимостью при комнатной температуре обладают таллий и индий ( около 50 %); растворимостью от 1 до 10 % обладают цезий, рубидий, кадмий, цинк, свинец, висмут, олово, галлий; от 0 1 до % - натрий, калий, магний, кальций, стронций, барий; от 0 01 до 0 1 % - литий, серебро, золото, торий; от 0 01 до 0 001 % - медь, алюминий и марганец. Практически нерастворимы в ртути металлы семейства железа, а также бериллий, германий, титан, цирконий, мышьяк, сурьма, ванадий, тантал, хром, молибден, вольфрам и уран. Для некоторых металлов растворимость в ртути сильно увеличивается с увеличением температуры. Известны амальгамы нерастворимых в ртути металлов; эти системы представляют собой коллоидные растворы или взвеси в ртути. [22]
Растворимость металлов в чистых солях обычно выше, чем в смесях солей, в особенности с резко различной природой катионов. [23]
На растворимость металлов в расплавленных солях сильное влияние оказывает состав солевой фазы. Наибольшая растворимость металлов отмечается в соли именно того металла, который растворяется. Этим облегчается образование субсоединений данного металла. [24]
По растворимости металлов в ртути была намечена общая закономерность, связанная со строением внешних rf - электронных оболочек их атомов. Если эти оболочки полностью свободны ( ряды аналогов 1 и 2), то металлы энергично взаимодействуют с ртутью, обра. При наличии частично заполненных d - оболочек ( ряды 3 - 10) металлы малорастворнмы или практически нерастворимы в ртути. Наконец, при наличии вполне заполненных d - оболочск ( ряды 11 - 15) растворимость металлов вновь возрастает, но уже без резко выраженной тенденции к образованию соединений с ртутью. По мере повышения номера периода, в котором находится данный элемент, растворимость металла в ртути обычно возрастает. [25]
 |
Микроструктура паяного соединения при контактно-реактивной пайке магния серебром. Температура пайки 520 С, время выдержки 10 мни, Х150. [26] |
При растворимости взаимодействующих металлов фронт контактного плавления плоский, диффузии по границам зерен и в объеме зерна мало различаются. [27]
Повышение растворимости металла в стекле типа золотой рубин благодаря присутствию Sn Вейль [60] объясняет стремлением закисного или окисного олова связывать атомы металла в соединения. [28]
Степень растворимости металла в электролите зависит прежде всего от его природы. Имеются металлы, например натрий, весьма бурно растворяющиеся даже в воде. Цинк и железо, не растворимые заметно в воде, легко растворяются в кислотах. Такие же металлы, как золото и платина, имеют незначительное стремление к растворению. [29]
Уменьшение растворимости металла в расплавленных солях наблюдается при введении в расплав соли более электроотрицательного металла. Иногда растворимость выделяемого металла так велика, что только введение понижающих растворимость добавок позволяет практически осуществить процесс. [30]
Страницы: 1 2 3 4