Растворимость - оксид
Cтраница 3
Приготовление ингибитора возможно непосредственно на предприятиях - потребителях холода. Следует иметь в виду, что растворимость оксида кальция падает с повышением температуры. [31]
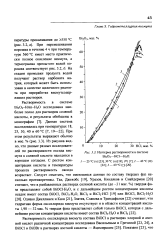 |
Изотерма растворимости в системе Bi2O3 - HC1 - Н2О. [32] |
При этом результаты выражают обычно в мае. Из рисунка видно, что данные разных исследователей по растворимости оксида висмута в соляной кислоте находятся в хорошем согласии. [33]
На практике большей частью с отходящими газами выбрасываются NO и NO2 при их одновременном присутствии. Основная сложность абсорбционных процессов связана с низкой химической активностью и растворимостью оксида азота. Имеется несколько путей решения этой проблемы: 1) полное окисление NO и NO2 в газовой фазе; 2) частичное окисление NO в NO2, приводящее к образованию эквимолекулярной смеси NO и NO2; 3) использование селективных абсорбентов; 4) окисление в жидкой фазе или использование жидкофазных катализаторов абсорбции и перевода NO в химически активные соединения. [34]
Оксиды Ga2O3, In2O3 и Т12О3 в воде практически нерастворимы. Заметное усиление основных свойств в ряду Ga2O3 - In2O3 - Т12О3 проявляется в возрастающей растворимости оксидов в кислотах. [35]
Для выяснения механизма реакций хлорирования в расплаве солей и особенностей процесса в целом следует рассмотреть влияние таких факторов, как растворимость оксидов и хлорирующих агентов в расплаве, физические и химические свойства расплавленных солей, в среде которых проводится хлорирование, а также углерода, используемого в качестве восстановителя. [36]
О протекании такой реакции в растворе должно свидетельствовать увеличение растворимости солей серебра, его гидроксида и оксида. Опыты показали [11], что в 0 5 - 10 - 3М растворе амидокомплекса [ Pt ( NH3) 5NH2 ] 3 растворимость свежеприготовленного оксида серебра действительно увеличивается на два порядка, а в 0 25 - 10 - 3 М растворе [ Pt ( NH3) 4 ( NH2) Cl ] 2 примерно также на два порядка увеличивается растворимость хлорида серебра. [37]
Зато саморазряд Ag-Cd - аккумулятора очень мал, так как кадмий не может вытеснить водород из раствора КОН. Растворимость оксида кадмия в щелочном растворе значительно меньше, чем у оксида цинка. Поэтому отдельные дендриты при образовании кадмиевой губки, как правило, не растут и коротких замыканий не вызывают. Срок службы серебряно-кадмиевых аккумуляторов получается больше, чем у серебряно-цинковых. Большим достоинством серебряно-кадмиевых аккумуляторов является то, что их можно делать герметичными аналогично никель-кадмиевым аккумуляторам. [38]
Гидроксид магния проявляет только основные свойства, хотя и слабые. Гидроксиды остальных элементов являются сильными основаниями. В этом же направлении увеличивается растворимость оксидов и гидроксидов металлов. [39]
Некоторые примеси, например алюминий в очень небольших количествах, понижают не только скорость растворения кремнезема, но и равновесную растворимость за счет их хемосорб-ции на поверхности кремнезема даже в количествах менее мономолекулярного слоя. Джефкотт и Джонстон [ 179а ] установили, что кажущаяся растворимость аморфного мелкодисперсного кремнезема в воде, равная, по их данным, 0 017 % при 37 С, понижается до 0 003 - 0 0097 % при добавлении к системе оксида алюминия и до 0 0001 % в присутствии алюминия в виде пудры. Поскольку было показано, что растворимость суспендированного оксида алюминия также подавляется добавлением кремнезема, то, вероятно, поверхность, содержащая одновременно SiO2 и А12О3, формируется на обеих фазах - как на кремнеземе, так и на оксиде алюминия - и имеет более низкую растворимость по сравнению с каким-либо одним из оксидов. [40]
Анодизационное покрытие состоит из двух слоев: пористого толстого внешнего слоя и тонкого слоя внутреннего, который является плотным и электроизоляционным. Последний называют барьерным или диэлектрическим слоем, составляющим 0 5 - 2 % общей толщины пленки. Этот слой образуется в начале анодирования при высоком напряжении, и его толщина изменяется прямо пропорционально рабочему напряжению и обратно пропорционально растворимости оксида в данном электролите. Средняя толщина диэлектрического слоя анодных пленок равна 0 03 - 0 05 мкм. Верхний слой оксидной пленки имеет микропористую структуру. [41]
Хотя таллий и образует несколько минералов, например лоран-дит TlAsS2 и крукезит ( Tl Cu, Ag) 2Se, они также весьма редки. Это подтверждается валовым составом указанных минералов. Основным сырьем для получения таллия служат полиметаллические руды, в которых он присутствует в виде примеси. Извлечение таллия из пыли, получающейся при окислительном обжиге этих руд, основано на растворимости оксида таллия в горячей воде. Полученный гидроксид переводят в сульфат таллия, который и подвергают электролизу. Существуют способы, по которым сначала получают плохо растворимый Т1С1, который восстанавливают до металла цинком. Возможно также восстановление оксида таллия углем или водородом. [42]
Хотя таллий и образует несколько минералов, например лорандит TlAsS2 и крукезит ( Tl Cu Ag) 2Se, они также весьма редки. Это подтверждается валовым составом указанных минералов. Основным сырьем для получения таллия служат полиметаллические руды, в которых он присутствует в виде примеси. Извлечение таллия из пыли, получающейся при окислительном обжиге этих руд, основано на растворимости оксида таллия в горячей воде. Полученный гидрок-сид переводят в сульфат таллия, который и подвергают электролизу. [43]
Соляная кислота является в настоящее время самым дешевым и эффективным растворителем окалины и продуктов атмосферной коррозии. При предпусковой очистке она проникает через поры окалины и ржавчины, растворяет оксид железа II и металл. Подтравленные отложения переходят в раствор в виде взвеси, которая затем постепенно растворяется в объеме раствора. Ранее считалось, что в растворах соляной кислоты лишь 50 % оксидов железа находится в растворенном состоянии. Количество взвеси в кислоте зависит от растворимости оксидов железа, а она в свою очередь от температуры и скорости движения раствора. При температурах 60 - 70 С 3 - 5 % - ные растворы соляной кислоты, циркулирующие со скоростью 0 5 - 1 5 м / с, с достаточно высокой скоростью переводят оксиды железа в растворенное состояние. [44]
Цинк и кадмий близки друг другу, в то же время ртуть заметно отличается от них как по своему агрегатному состоянию, так и по химическому поведению. Например, она образует ион Hg2, где формально ее степень окисления 1; имеет аномально высокий потенциал ионизации и отличается от цинка и кадмия положительным значением нормального окислительно-восстановительного потенциала. Цинк и кадмий вытесняют водород из разбавленных кислот, а ртуть нет. Радиусы атомов в подгруппе незначительно возрастают от цинка к ртути, а радиусы ионов увеличиваются довольно резко. Соответственно этому увеличивается доля ковалент-ной составляющей в связи с электроотрицательными элементами и падает растворимость оксидов и сульфидов. Гидроксид цинка Zn ( OH) 2 амфотерен, Cd ( OH) проявляет более основные свойства, a Hg ( OH) a - соединение неустойчивое и представляет собой слабое основание. Аномалии в свойствах ртути объясняются так называемым эффектом инертной пары. Известно, что п52 - электроны способны проникать к ядру сквозь экран из предшествующих электронов. Поэтому Gs-электронная пара, несмотря на то, что расположена после полностью занятых 4fu - и 5йш - подуровней, очень устойчива к воздействиям. Этот эффект сказывается далее по периоду на свойствах таллия, свинца, висмута. Вероятно поэтому ртуть относится к благородным металлам, не вытесняющим водород из кислот. [45]
Страницы: 1 2 3 4