Растворимость - большинство
Cтраница 2
Растворимость большинства компонентов в алюминии при понижении температуры уменьшается ( рис. 160), что позволяет упрочнять сплавы путем закалки и старения. [16]
Растворимость большинства белков зависит от ионной силы, рН я концентрации органических растворителей. Рассмотрим влияние каждого из из этих факторов. [17]
Растворимость большинства осадков увеличивается с повышением температуры раствора. Растворимость CaSO4 достигает максимума при 40 С, а при дальнейшем повышении температуры она уменьшается. [18]
Растворимость большинства газов в воде по порядку величины не отличается от растворимости воздуха. Исключения составляют газы, которые химически соединяются с водой или сильно диссоциируют на ионы; к их числу относятся СО2 ( растворимость 1713 мл-л-1 лри 0 С), H2S ( 4670 мл-л - лри 0 С), а также SO2 и NHs. [19]
Растворимость большинства ве-еств уменьшается с понижением температуры, поэтому при охла-дении горячих насыщенных растворов избыток растворенного ве-ества обычно выделяется. Однако, если производить охлаждение: торожно и медленно, защитив при этом раствор от возможности шадания в него частиц растворенного вещества извне, то выделе - 1я его из раствора может и не произойти. Это явление было открыто и подробно изучено русским ака-миком Т. Е. Ловицем ( 1794 г.), который назвал такие растворы с-р есыщенн ы м и. В спокойном состоянии они могут годами даваться без изменения. Но стоит только бросить в раствор кри -: аллик того вещества, которое в нем растворено, как тотчас же экруг него начинают расти другие кристаллы и через короткое оемя весь избыток растворенного вещества выкристаллизовы-зется. [20]
Растворимость большинства нитратов в воде с повышением температуры возрастает. Этим свойством часто пользуются при получении нитратов в лабораторных и заводских условиях. [21]
Растворимость большинства газов и неполярных жидкостей в воде при температурах до 250 С весьма мала. Высокие давления вплоть до нескольких сотен мегапаскалей существенным образом не повышают эту растворимость. По этой причине при описании растворов газов и неполярных жидкостей в воде часто находят применение закономерности разбавленных растворов. [22]
Растворимости большинства газов, таких, как двуокись серы, сероводород, двуокись углерода и других, а также фторидов невелики, и их концентрации в разбавленных растворах электролитов очень близки к активностям, поэтому для определения этих газов используется потенциометрический метод. [23]
Растворимость большинства газов в воде по порядку величины не отличается от растворимости воздуха. Исключения составляют газы, которые химически соединяются с водой или сильно диссоциируют на ионы; к числу таких газов относятся С02 ( растворимость 1713 мл / л при О С), H2S ( 4670 мл / л при О С), а также S02 и NH3, обладающие исключительно высокой растворимостью. [24]
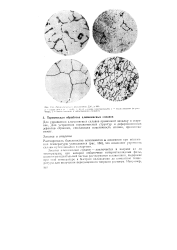 |
У. Mmqm ityi t l Д Р1 мимина Д10, X 200. [25] |
Растворимость большинства компонентов в алюминии при понижении температуры уменьшается ( рис. 160), что позволяет упрочнять сплавы путем закалки и старения. [26]
 |
Микроструктура дуралюмина Д16 после. [27] |
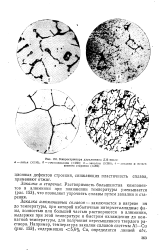
Растворимость большинства компонентов в алюминии при понижении температуры уменьшается ( рис. 153), что позволяет упрочнять сплавы путем закалки и старения. [28]
Растворимость большинства ве ществ уменьшается с пони / ксилем температуры, поэтому при охлаждения горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение осторожно н медленно, защитив при этом раствор от возможности попадания в него частиц растворенного вещества извне, то вияеле-пня его из раствора может н не произойти, В этом случае получится р; сп с-р, содержащий значительно больше растворенного пещсстпа, чем сто требуется для насыщения при данной температуре. Это явление было открыто и подробно изучаю русским ака-1 демпком Т. Е. Ловнцем ( 1794 г.), который назвал такие растворы п е р е с ы щ е н н ы м и. В спокойном состоянии они могут годами оставаться без изменения. Но стоит только бросить в раствор при - сталлик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы н через короткое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясения раствора, а также от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяется значительное количество теплоты, так что сосуд с раствором за метно нагревается. [29]
Растворимость большинства органических веществ в воде значительно понижается в присутствии неорганических солей. [30]
Страницы: 1 2 3 4