Растворимость - большинство
Cтраница 3
Растворимость большинства ионных пар в органической фазе невелика. [31]
Растворимость большинства ве ществ уменьшается с понижением температуры, поэтому при охла ждении горячих насыщенных растворов избыток растворенного ве щества обычно выделяется. Однако, если производить охлаждение осторожно и медленно, защитив при этом раствор от возможности попадания в него частиц растворенного вещества извне, то выделе ния его из раствора может и не произойти. В этом случае полу, чится раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной темпера туре. Это явление было открыто и подробно изучено русским ака-демиком Т. Е. Ловицем ( 1794 г.), который назвал такие растворы пересыщенными. В спокойном состоянии они могут годами оставаться без изменения. Но стоит только бросить в раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясения раствора, а также от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяется значительное количество теплоты, так что сосуд с раствором за-метно нагревается. [32]
Растворимость большинства твердых тел с повышением температуры возрастает, а растворимость газов при повышении температуры понижается. [33]
Растворимость большинства неорганических соединений в смесях воды с органическим растворителем заметно меньше, чем в чистой воде. Данные о растворимости сульфата кальция, приведенные в табл. 5 - 5, типичны для этого явления. [34]
Растворимость большинства органических веществ в воде значительно понижается в присутствии неорганических солей. [35]
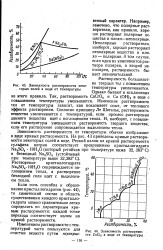 |
Зависимость растворимости неко -. торых солей в воде от температуры.| Зависимость растворимости ZnCb в воде от температуры. [36] |
Растворимость большинства твердых тел с повышением температуры увеличивается. [37]
Растворимость большинства соединений катионов с анионами неорганических кислот резко понижается при введении органических растворителей. Так, например, сернокислый свинец или кремнефтористый калий заметно растворимы в воде, но практически нерастворимы в 50 % - ном спирте. При определении калия в виде хлоропла-тината или перхлората и натрия в виде тройной соли ( натрий-цинк-уранилацетат) также применяют спирт, потому что соответствующие соли заметно растворимы в воде. [38]
Растворимость большинства органических веществ в воде значительно понижается в присутствии неорганических солей. [39]
Растворимость большинства твердых тел с повышением температуры увеличивается. Однако бывают и исключения из этого правила. Так, растворимость СаСг04 и Са ( ОН) 2 в воде с повышением температуры уменьшается. Изменение растворимости тел от температуры зависит, как показывает опыт, от теплового эффекта растворения. Согласно принципу Ле Шателье растворимость вещества увеличивается с температурой, если процесс растворения данного вещества идет с поглощением теплоты. [40]
Поскольку растворимость большинства белков вблизи их изоэлектрической точки оказывается минимальной, можно подобрать такое значение рН, при котором нужный белок выпадет в осадок, а большинство загрязняющих белков останется а растворе. [41]
Определена растворимость большинства выделенных солей в воде и сделаны микрофотографии их кристаллов. [42]
Зависимость растворимости большинства белков от рН при данной ионной силе описывается U-образной кривой с минимумом вблизи изо-электрической точки. Соответствующие кривые для [ 3-лактоглобулина приведены на фиг. [43]
Коэффициент растворимости большинства твер-дых веществ при повышении температуры возрастает. [44]
Тогда как растворимость большинства твердых тел при повышении температуры раствора увеличивается, растворимость большинства газов уменьшается. [45]
Страницы: 1 2 3 4