Растворимость - большинство - соль
Cтраница 1
Растворимость большинства солей уменьшается с понижением температуры. В кристаллизаторах этого типа в результате испарения части растворителя может создаваться также дополнительное пересыщение. [1]
Растворимость большинства солей с повышением температуры повышается. Так, растворимость сульфата кобальта увеличивается почти в два раза с повышением температуры раствора от 15 до 100 С. Аналогичная зависимость характерна и для хлорида серебра, сульфата бария и других солей. В качественном анализе увеличение растворимости солей с повышением температуры иногда используют для обнаружения и разделения некоторых ионов. Так, ионы свинца отделяют от ионов серебра, переводя их в хлориды, а затем нагревают раствор с осадком до температуры кипения. При этом осадок РЬС12 практически полностью растворяется, a AgCI остается в твердой фазе. Зависимость растворимости солей от концентрации реагирующих компонентов рассмотрена ниже. [2]
С повышением температуры растворимость большинства солей возрастает. Смеси солей различного состава имеют отличную от приведенной выше растворимость. Длительность растворяющего воздействия цементного раствора на солевую стенку скважины значительно меньше, чем у воды. [3]
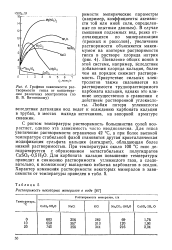 |
Графики зависимости растворимости гипса от концентра -. ции различных электролитов ( по В. В. Витвицкому. [4] |
С ростом температуры растворимость большинства солей возрастает, однако эта зависимость часто неоднозначна. Для гипса увеличение растворимости ограничено 42 С, а при более высокой температуре стабильной фазой становится другая кристаллическая модификация сульфата кальция ( ангидрит), обладающая более низкой растворимостью. Для карбоната кальция повышение температуры приводит к снижению растворимости углекислого газа, а следовательно, к возможному выпадению избытка карбонатов в осадок. [5]
С ростом давления растворимость большинства солей возрастает. В табл. 7 приведены данные, показывающие увеличение растворимости гипса. [6]
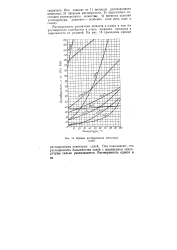 |
Кривые растворимости некоторых солей. [7] |
Они показывают, что растворимость большинства солей с повышением температуры сильно увеличивается. [8]
При температурах выще 373 К растворимость большинства солей, подобно гипсу, уменьшается. При медленном охлаждении насыщенного раствора из него может выпадать осадок в виде кристаллов, а в другом случае некоторые вещества образуются при охлаждении пересыщенного раствора с большим содержанием новообразований. Такой раствор неустойчив и из него при встряхивании или введении электролитов быстро выделяется избыток продуктов растворения. [9]
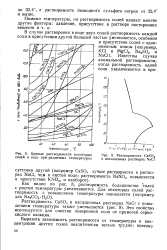 |
Кривые растворимости некоторых солей в воде при различных температурах.| Растворимость CaSO4 в насыщенных растворах NaCl. [10] |
Как видно из рис. 8, растворимость большинства солей с ростом температуры увеличивается. [11]
Метод кристаллизации при охлаждении раствора применяется чаще, так как растворимость большинства солей уменьшается с понижением температуры. [12]
Увеличение температуры приводит к росту одновременно и скорости растворения, и произведения растворимости большинства солей. В результате скорость реакций увеличивается. [13]
Кристаллизация основана на изменении растворимости твердых веществ в жидкостях. Растворимость большинства солей увеличивается по мере повышения температуры растворителя. Поэтому для кристаллизации NaCl достаточно выпарить часть растворителя без последующего охлаждения раствора. Кристаллы поваренной соли выпадают в осадок сразу после того, как порог насыщения будет пройден. Если кроме NaCl в растворе содержатся другие соединения ( например NaOH), растворимость которых возрастает с повышением температуры, то по мере выпаривания воды удается осадить практически весь хлорид натрия. При последующем охлаждении раствора в осадок выпадает обессоленный едкий натр. Этот процесс широко применяется в хлорной промышленности93 и в производстве неорганических солей - так называемая дробная кристаллизация, первой стадией которой является осаждение NaCl из горячего раствора. [14]
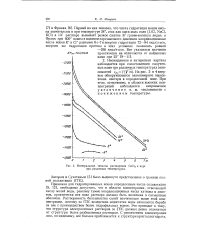 |
Интегральные теплоты растворения CoClg в воде при различных температурах. [15] |
Страницы: 1 2