Растворимость - разное вещество
Cтраница 2
АдВу выражение ПР имеет вид: ПР [ А ] - С [ В ] У. Числовые значения произведений растворимости разных веществ могут быть очень различны. Они весьма важны для химического анализа. [16]
Для водных растворов твердых веществ при данной температуре существует предел насыщения. Растворимость разных веществ при равной температуре и одного и того же вещества при разных температурах различна. [17]
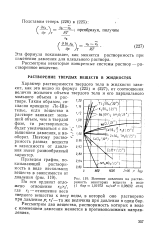 |
Влияние давления на раство-римость некоторых веществ в воде d бар 1 01972 кг / см 0 98692 атм. [18] |
Характер растворимости твердого тела в жидкости зависит, как это видно из формул ( 225) и ( 227), от соотношения величин мольного объема твердого тела и его парциального мольного объема в растворе. Таким образом, согласно принципу Ле-Ша - телье, если вещество в растворе занимает меньший объем, чем в твердой фазе, то растворимость будет увеличиваться с повышением давления, и на - 1 оо оборот. Поэтому растворимость разных веществ в зависимости от давления имеет разнообразный характер. [19]
Растворимость веществ в воде в значительной мере зависит от температуры. Растворимость твердых веществ и жидкостей с повышением температуры, как правило, возрастает. Однако температурная зависимость растворимости разных веществ самая различная. Например, растворимость хлорида калия с увеличением температуры растет очень сильно, а хлорида натрия - незначительно. Растворимость анилина при обычной температуре очень мала, но выше 40 С он растворяется в воде в неограниченных количествах. [20]
Так как сильные электролиты в очень разбавленных растворах почти нацело диссоциированы, растворимость малорастворимых солей иногда бывает удобно выражать при помощи произведения растворимости ( ПР), представляющего собой произведение концентраций ионов малорастворимого сильного электролита в его насыщенном растворе. В общем случае малорастворимого сильного электролита типа АяВу выражение ПР имеет вид: ПР [ А ] [ В ] и. Числовые значения произведений растворимости разных веществ могут быть очень различны. Они важны для химического анализа. [21]
Так как сильные электролиты в очень разбавленных растворах почти нацело диссоциированы, растворимость малорастворимых солей иногда бывает удобно выражать при помощи произведения растворимости ( ПР), представляющего собой произведение концентраций ионов м а л о р ас т в о р и мого сильного электролита в его насыщенном растворе. В общем случае малорастворимого сильного электролита типа АХЕУ выражение ПР имеет вид: ПР [ А ] [ Вр. Числовые значения произведений растворимости разных веществ могут быть очень различны. Они важны для химического анализа. [22]
Так как сильные электролиты в очень разбавленных растворах почти нацело диссоциированы, растворимость малорастворимых солей иногда бывает удобно выражать при помощи произведения растворимости ( ПР), представляющего собой произведение концентраций ионов малорастворимого сильного электролита в его насыщенном растворе. В общем случае малорастворимого сильного электролита типа АХЕУ выражение ПР имеет вид: ПР [ А ] В ] а. Числовые значения произведений растворимости разных веществ могут быть очень различны. Они важны для химического анализа. [23]
Концентрация насыщенного раствора численно определяет растворимость вещества при данных условиях. К сожалению, до настоящего времени не существует единой научной теории, позволяющей вывести общие законы растворимости. Подобное положение в значительной степени обусловлено тем, что растворимость разных веществ очень различно зависит от температуры. [24]
Концентрация насыщенного раствора определяет растворимость вещества при данных условиях. К сожалению, до настоящего времени не существует теории, позволяющей объединить результаты отдельных исследований и вывести общие законы растворимости. Подобное положение в значительной степени обусловлено тем, что растворимость разных веществ очень различно зависит от температуры. [25]
Концентрация насыщенного раствора численно определяет растворимость вещества при данных условиях. К сожалению, до настоящего времени не существует теории, позволяющей объединить результаты отдельных исследований и вывести общие законы растворимости. Подобное положение обусловлено в значительной степени тем, что растворимость разных веществ очень различно зависит от температуры. [26]
Таким образом, влияние солей на растворимость разных веществ довольно сложно. Я - Самойлову [44,45], соли оказывают одновременно и обезвоживающее ( высаливающее) и оводняющее ( всаливающее) действие. Суммарный, эффект зависит от превалирующего влияния. Очевидно, действие данного электролита зависит и от природы растворенного в воде вещества. Одна и та же соль может и повышать и понижать растворимость разных веществ в воде. На рис. 26 показано изменение растворимости разных органических веществе в воде в присутствии сульфата магния. Растворимость в чистой воде принята равной единице. Следовательно, введение сульфата магния повышает растворимость пикриновой кислоты, уменьшает растворимость анилина и почти не оказывает влияния на растворимость бензойной кислоты. [27]
Таким образом влияние солей на растворимость разных веществ в воде довольно сложно. Самойлову ( 145, 146), соли оказывают одновременно и обезвоживающее ( высаливающее) и озодняющее ( всаливающее) действия. Суммарный эффект зависит от превалирующего влияния. Очевидно, действие данного электролита зависит н от природы растворенного в воде вещества. Одна и та же соль может и повышать и понижать растворимость разных веществ в воде. На рис. 39 показано изменение растворимости разных органических веществ в воде в присутствии сульфата магния. Растворимость в чистой воде принята равной единице. Введение сульфата магния повышает растворимость пикриновой кислоты, уменьшает растворимость анилина и почти не оказывает влияния на растворимость бензойной кислоты. [28]
Страницы: 1 2