Растворимость - малорастворимое соединение
Cтраница 3
С помощью метода электропроводности легко можно вычислять также и произведение растворимости малорастворимых соединений. [31]
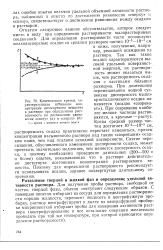 |
Кинетические кривые, характеризующие изменение концентрации исследуемого вещества в растворе при определении растворимости по достижению равновесия снизу ( а и сверху ( б. [32] |
Отметим следующее важное обстоятельство, которое следует иметь в виду при определении растворимости малорастворимых соединений. [33]
Известны многие случаи, когда прибавление избытка осадителя сначала приводит к снижению растворимости малорастворимого соединения, а затем к ее увеличению. Поэтому в таких случаях необходимо иметь в виду, что обычный расчет растворимости при избытке одноименных ионов приводит к ошибочным результатам. Правило произведения растворимости основано на том, что с ростом концентрации одноименных ионов увеличивается вероятность их встречи с противоположно заряженными ионами, с которыми образуется осадок. В связи с этим концентрация вещества и его растворимость уменьшается. При комплексообразовании концентрация осаждаемых ионов также уменьшается, но в результате этой реакции растворимость осадка растет. Вот почему правило произведения растворимости нельзя применять механически. Известны и такие осадки, растворимость которых под действием избытка осадителя уменьшается. [34]
Как влияют температура, рН, добавление одноименных ионов и посторонних электролитов на растворимость малорастворимых соединений. [35]
В реакциях, сопровождающихся образованием осадков, предельная концентрация анализируемого иона зависит от произведения растворимости малорастворимого соединения. Так, в рассмотренном примере трех малорастворимых соединений серебра, образованных хромат -, хлорид - и сульфид-ионами, последний из них характеризуется наименьшей предельной концентрацией. Однако определяемая экспериментально предельная концентрация иона всегда больше концентрации того же иона, вычисленной из величины ПР малорастворимого соединения. Это, естественно, вызвано тем, что для образования отчетливо видимого помутнения или небольшого осадка необходима большая концентрация ионов по сравнению с расчетной. [36]
Дробное или фракционированное осаждение ионов из смеси их происходит в той последовательности, в какой достигаются пронз-ведения растворимости малорастворимых соединений, образующихся при действии данного реактива. На последовательность осаждения ионов большое влияние оказывает концентрация ионов в растворе. При сильном изменении концентрации ионов, образующих малорастворимое соединение, последовательность осаждения ионов может измениться. [37]
Дробное или фракционированное осаждение ионов из смес их происходит в той последовательности, в какой достигают произведения растворимости малорастворимых соединений, о. На последовател; ность осаждения ионов большое влияние оказывает концентрат-ионов в растворе. При сильном изменении концентрации ионо образующих малорастворимое соединение, последовательное. [38]
Естественно, что в случае тринарного, тетрарного и более сложного соединения произведение растворимости будет другим, но всегда растворимость малорастворимого соединения не должна превышать 10 - 6 г в 1 л раствора. [39]
Высокая чувствительность количественного определения составляет неоценимое достоинство метода радиоактивных индикаторов при решении таких задач, как, например, изучение растворимости малорастворимых соединений или измерение давления насыщенного пара твердых веществ. С помощью радиоактивных индикаторов были созданы принципиально новые методы количественного анализа, такие, как активационный анализ, метод изотопного разбавления и др. В ряде случаев использование радиоактивных индикаторов позволяет автоматизировать процедуру анализа. [40]
Величина Avz, вычисляемая по соотношению (5.4), для процесса растворения ионных соединений всегда положительна и в соответствии с (5.3) с увеличением ионной силы растворимость малорастворимого соединения и его ПР возрастают. [41]
Величина Avz /, вычисляемая по соотношению (5.4), для процесса растворения ионных соединений всегда положительна и в соответствии с (5.3) с увеличением ионной силы растворимость малорастворимого соединения и его ПР возрастают. [42]
VIII введены расчеты по определению ионной силы растворов сильных электролитов и активностей ионов, вычислению концентраций ионов в растворах многоосновных кислот, а также влияние ионной силы раствора на растворимость малорастворимых соединений. [43]
Полнота ( количественность) осаждения определяется растворимостью осаждаемого вещества во время образования, фильтрования и ггоомывания осадка. Растворимость малорастворимого соединения зависит от многих факторов. Основные из них: присутствие в осаждаемом растворе электролитов, кислотность рас ь-вора, присутствие комплексующих веществ, температура, природа растворителя. [44]
Очень близкий к описанному способ состоит в следующем. Поскольку растворимость малорастворимого соединения зависит от рН, можно начать осаждение в кислой среде, в которой образующийся осадок хорошо растворяется, и очень медленно нейтрализовать раствор, пока не получится среда, в которой это соединение совершенно нерастворимо. В таких условиях сначала образуются кристаллические зародыши, которые увеличиваются в размерах по мере того, как понижается растворимость осаждаемого соединения. [45]
Страницы: 1 2 3 4