Растворимость - осаждаемое соединение
Cтраница 2
Анализ кривой ( рис. 54) и данных табл. 19 позволяет сделать заклю-ч ение, что чем меньше растворимость осаждаемого соединения, тем больше скачок титрования. [16]
Следующий ион начинает переходить в осадок, когда отношение концентраций первого и второго ионов достигнет значения, равного отношению произведений растворимости осаждаемых соединений, содержащих эти ионы. [17]
Согласно правилу произведения растворимости образование осадков происходит лишь при условии, если произведение концентраций соответствующих ионов в растворе превышает величину произведения растворимости осаждаемого соединения при данной температуре. Так как абсолютно нерастворимых в воде веществ не существует, то ни одно осаждение не бывает совершенно полным. Полнота осаждения в первую очередь зависит от количества прибавленного осадителя. [18]
Из всего сказанного видно что поведение комплексных солей реакциях, осаждения определяется главным образом соотношением между величинами константы нестойкости комплекса и произведения растворимости осаждаемого соединения. Чем больше / ( ест - ч меньше произведение растворимости, тем больше оснований ожидать, что осадок будет образовываться, и наоборот. [19]
Следовательно, согласно правилу произведения растворимости, образование осадков происходит лишь при условии, если произведение концентраций ( точнее активностей соответствующих ионов превысит величину произведения растворимости осаждаемого соединения при данной температуре. [20]
Из всего сказанного мы видим, что поведение комплексных солей при реакциях осаждения определяется, главным образом, соотношением между величинами константы неустойчивости комплекса и произведения растворимости осаждаемого соединения. ПР, тем больше оснований ожидать, что осадок образуется, и наоборот. [21]
Следовательно, согласно правилу произведения растворимости, образование осадков происходит лишь при условии, если произведение концентраций ( точнее активностей) соответствующих ионов превысит величину произведения растворимости осаждаемого соединения при данной температуре. [22]
Из всего сказанного мы видим, что поведение комплексных солей при реакциях осаждения определяется, главным образом, соотношением между величинами константы неустойчивости комплекса и произведения растворимости осаждаемого соединения. ПР меньше, тем больше оснований ожидать, что осадок образуется, и наоборот. [23]
Следовательно, согласно правилу произведения растворимости o6j) 03oeajjMe - & cft & KO8 происходит лишь при условии, если произведение концентраций ( точнее, активностей ] соответствующих ионов превысит величину произведения растворимости осаждаемого соединения при данной температуре. [24]
Полнота переведения ионов из жидкой фазы ( анализируемого раствора) в твердую фазу ( осадок) при наличии в растворе только осаждаемых катионов или анионов легко может быть вычислена по значению константы растворимости осаждаемого соединения ( см. гл. При разделении ионов в растворе присутствуют также другие катионы или анионы, от которых следует отделить переводимое в твердую фазу вещество. Часто эти катионы или анионы в большей или в меньшей степени соосаждаются и фактическая полнота разделения оказывается значительно меньше теоретической. Поэтому при разделении путем осаждения теоретические данные всегда следует проверить экспериментально, например с помощью радиоактивных индикаторов. [25]
При осаждении даже самых труднорастворимых веществ все же остается некоторое количество осаждаемых ионов, так как абсолютно нерастворимых веществ в природе нет. Чем больше растворимость осаждаемого соединения, тем менее точен результат весового определения. Поэтому основная задача аналитика сводится не только к получению осадка, отличающегося определенной формой и структурой, но и к тому, чтобы потери вещества, обусловливаемые неполнотой осаждения, были сведены к допускаемому в этих случаях минимуму. [26]
При осаждении даже самых малорастворимых веществ все же остается некоторое количество осаждаемых ионов, так как абсолютно нерастворимых веществ в природе нет. Чем больше растворимость осаждаемого соединения, тем менее точен результат весового определения. Поэтому основная задача аналитика сводится не только к получению осадка, отличающегося определенной формой и структурой, но и к тому, чтобы потери вещества, обусловливаемые неполнотой осаждения, были сведены к допускаемому в этих случаях минимуму. [27]
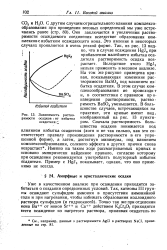 |
Зависимость растворимости осадков ( от избытка осадителя. [28] |
Оно заключается в увеличении растворимости осаждаемого соединения вследствие образования комплексов с избытком осаждающего иона. Это явление в некоторых случаях проявляется в очень резкой форме. Так, из рис. 13 видно, что в случае осаждения HgJ2 при прибавлении малейшего избытка оса-дителя растворимость осадка возрастает. [29]
Осадитель должен легко удаляться при прокаливании осадка, поэтому осаждают серной кислотой, а не ее солями. Реагент-оса-дитель необходим в количестве, обеспечивающем превышение растворимости осаждаемого соединения и практически полное его осаждение. В гравиметрии осаждение считается практически полным, если в растворе остается не более 2 - 10 - 4 г осаждаемого вещества. Полнота осаждения достигается использованием полуторного объема осадителя по сравнению с рассчитанным. Избыток сульфат-ионов понижает растворимость сульфата бария. [30]
Страницы: 1 2 3 4