Растворимость - осаждаемое соединение
Cтраница 3
Согласно правилу произведения растворимости ( см. Книга I, Качественный анализ, гл. I, § 32) образование осадков происходит лишь при условии, если произведение концентраций соответствующих ионов в растворе превышает величину произведения растворимости осаждаемого соединения при данной температуре. Так как абсолютно нерастворимых в воде веществ не существует, то ни одно осаждение не бывает совершенно полным. Полнота осаждения в первую очередь зависит от количества прибавленного осадителя. [31]
Согласно правилу произведения растворимости ( см. Качественный анализ, гл. I, § 32), образование осадков происходит лишь при условии, если произведение концентраций соответствующих ионов в растворе превышает величину произведения растворимости осаждаемого соединения при данной температуре. Так как абсолютно нерастворимых в воде веществ не существует, то ни одно осаждение не бывает совершенно полным. Степень полноты осаждения зависит от количества прибавленного осадителя. [32]
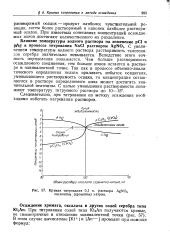 |
Кривая титрования 0 1 н. раствора AgNO3 оксалатом ( хроматом натрия. [33] |
С увеличением температуры водного раствора растворимость галогени-дов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в расто-ре в эквивалентной точке. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то Концентрация остающегося в растворе определяемого иона может достигать значительной величины. [34]
С увеличением температуры водного раствора растворимость галогенидов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в растворе в точке эквивалентности. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то концентрация остающегося в растворе определяемого иона может достигать значительной величины. С целью уменьшения растворимости понижают температуру титруемого раствооа до 10 - 15 С. [35]
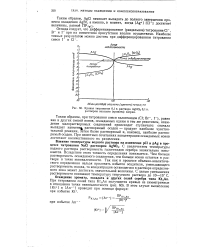 |
Кривая титрования 0 1 н. раствора AgNO3 0 1 н. раствором оксалата ( хромата натрия. [36] |
С увеличением температуры водного раствора растворимость галогенидов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в растворе в точке эквивалентности. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то концентрация остающегося в растворе определяемого иона может достигать значительной величины. С целью уменьшения растворимости понижают температуру титруемого раствора до ГО-15 С. [37]
С увеличением температуры водного раствора растворимость галогенидов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в растворе в точке эквивалентности. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то концентрация остающегося в растворе определяемого иона может достигать значительной величины. С целью уменьшения растворимости понижают температуру титруемого раствора до 10 - 15 С. [38]
Если оно не очень велико ( 10 - 5 моль / л) и выполнению последующих аналитических реакций не мешает, то горорят, что достигнуто практически полное осаждение. Но часто полное осаждение иона достигается лишь при соблюдении ряда особых условий. Полнота осаждения иона зависит от растворимости осаждаемого соединения, количества реактива-осадителя, его степени диссоциации, гидролизуемости, рН раствора и некоторых других факторов. [39]
Оно основано на последовательном осаждении отдельных ионов в виде труднорастворимых соединений, отличающихся друг от друга величинами произведений растворимости. При этом полнота разделения смеси ионов зависит от разницы в величинах произведений растворимости осаждаемых соединений и от соотношения первоначальных концентраций ионов в растворе. В первую очередь осаждаются ионы, образующие наименее растворимые соединения. Второй ион начинает переходить в осадок, когда отношение концентраций двух ионов достигнет значения, равного отношению величин произведений растворимости осаждаемых соединений. [40]
Но в уравнение произведения растворимости входит не только величина концентрации осаждающего иона, но также и осаждаемого. Если уменьшать концентрацию последнего в растворе путем связывания его в какой-либо малодиссоциированный комплексный ион, можно, очевидно, также сделать осаждение неполным или даже вовсе предупредить его. Для этого нужно, чтобы произведение концентраций соответствующих ионов в растворе стало меньше величины произведения растворимости осаждаемого соединения. [41]
Но в уравнение произведения растворимости входит не только величина концентрации осаждающего иона, но также и осаждаемого. Если уменьшать концентрацию последнего в растворе путем связывания его в какой-либо малодиссоциированный комплексный ион, можно, очевидно, также сделать осаждение непол ным или даже вовсе предупредить его. Для этого нужно, чтобы произведение концентраций соответствующих ионов в растворе стало меньше величины произведения растворимости осаждаемого соединения. [42]
Очень близкий к описанному способ состоит в следующем. Поскольку растворимость малорастворимого соединения зависит от рН, можно начать осаждение в кислой среде, в которой образующийся осадок хорошо растворяется, и очень медленно нейтрализовать раствор, пока не получится среда, в которой это соединение совершенно нерастворимо. В таких условиях сначала образуются кристаллические зародыши, которые увеличиваются в размерах по мере того, как понижается растворимость осаждаемого соединения. [43]
Очень близкий к описанному спсссб состоит в следующем. Поскольку растворимость малорастворимого соединения зависит от рН, можно начать осаждение в кислой среде, в которой образующийся осадок хорошо растворяется, и очень медленно нейтрализовать раствор, пока не получится среда, в которой это соединение совершенно нерастворимо. В таких условиях сначала образуются кристаллические зародыши, которые увеличиваются в размерах по мере того, как понижается растворимость осаждаемого соединения. Так, можно очень медленно создать аммиачную среду, пропуская через раствор постепенно, пузырек за пузырьком, газообразный аммиак, или же ввести в раствор мочевину1, которая при нагревании раствора медленно разлагается с образованием аммиака. Так получаются гидроокиси и соли, более чистые и легче отделяемые фильтрованием. [44]
Очень близкий к описанному спсссб ссстсит в следующем. Поскольку растворимость малорастворимого соединения зависит от рН, можно начать осаждение в кислой среде, в которой образующийся осадок хорошо растворяется, и очень медленно нейтрализовать раствор, пока не получится среда, в которой это соединение совершенно нерастворимо. В таких условиях сначала образуются кристаллические зародыши, которые увеличиваются в размерах по мере того, как понижается растворимость осаждаемого соединения. Так, можно очень медленно создать аммиачную среду, пропуская через раствор постепенно, пузырек за пузырьком, газообразный аммиак, или же ввести в раствор мочевину1, которая при нагревании раствора медленно разлагается с образованием аммиака. Так получаются гидроокиси и соли, более чистые и легче отделяемые фильтрованием. [45]
Страницы: 1 2 3 4