Растворимость - данное соединение
Cтраница 1
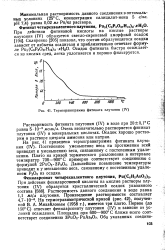 |
Термогравиграмма фитината плутония ( IV. [1] |
Растворимость данного соединения в воде равна 1 1 мг / л плутония. На термогравиметрической кривой ( рис. 42), полученной В. А. Михайловым ( 1958 г.), имеется три плато. Первое ( до 150 С) отвечает фениларсонату плутония ( IV) и зависит от условий осаждения. [2]
Обычно растворимость данного соединения тем выше, чем больше его сходство с растворителем. [3]
Факторами, определяющими как летучесть, так и растворимость данного соединения, являются размеры его молекул и интенсивность межмолекулярного взаимодействия. [4]
 |
Зависимость коэффициента фильтрации от концентрации исходного раствора фторида алюминия. Температура реакционной среды в процессе осаждения. [5] |
А - постоянная ( нормирующий множитель); L - растворимость данного соединения. [6]
Соотношением между гидрофобными частями и гидрофильными группами и обусловлена та или иная растворимость данного соединения в воде. Чем длиннее углеводородная цепь данной молекулы, тем менее растворимо данное соединение. Удлинение углеводородной цепи жирных кислот приводит к тому, что они теряют способность к растворению IB воде, однако благодаря наличию гидрэфиль-ных групп расплываются по ее поверхности, связываясь с поверхностным водным слоем своими гидрофильными группами. [7]
Однако коэффициент диффузии меняется при изменении условий электролиза лишь незначительно, а пределом увеличения концентрации электролита является растворимость данного соединения. Поэтому существенным сбразом изменить предельную плотность тока можно лишь изменяя толщину диффузионного слоя / путем перемешивания, Это уже будет случай конвективной диффузии. [8]
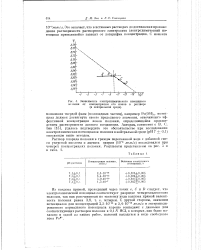 |
Зависимость электрохимического потенциала полония от концентрации его ионов в растворе ( в нейтральной среде. [9] |
Ро ( ОН) 4, потенциал должен достигнуть своего предельного значения, отвечающего эффективной концентрации ионов полония, определяющейся произведением растворимости данного соединения. Авторам, совместно с В. С. Зив [15], удалось подтвердить это обстоятельство при исследовании электрохимических потенциалов полония в нейтральной среде ( рН 7 0 1) описанным выше методом. [10]
Повышение концентрации в испаряемой воде ИОБОВ накипе-образующих соединений приводит к тому, что произведение их активных концентраций может получиться больше произведения растворимости данного соединения. В таком случае вода в испарителе оказывается пересыщенной этим соединением. Пересыщение может возникнуть не во всем объеме воды, заполняющей испаритель. [11]
В отличие от ионов функциональные группы не являются независимыми компонентами, а представляют собой активную часть молекулы, участвующую в реакции. Следовательно, остальная часть молекулы может влиять на растворимость данного соединения и его продуктов реакции в воде или в органических растворителях, на скорость и полноту протекания реакции, а также на цвет продуктов реакции при дневном или ультрафиолетовом освещении. В отдельных случаях оставшаяся часть молекулы органического вещества оказывает такое сильное влияние, что при исследовании ряда соединений на присутствие той или иной функциональной группы получаются отрицательные результаты, несмотря на то, что, как известно, эти реакции вполне применимы к другим веществам с такими же группами в молекуле. Как правило, однако, такие отступления влияют только на четкость наблюдаемой реакции. Таким образом, для одной и той же реакции величины открываемого минимума могут очень сильно колебаться даже при исследовании в одинаковых условиях соединений, содержащих одну и ту же функциональную группу. Это наглядно иллюстрируется данными, приведенными в приложениях ( стр. [12]
Очень помогают решению всей задачи радиоактивные индикаторы, которые вводят при синтезе соединений. На основе измерения активности получающихся растворов и оставшейся твердой фазы делают заключение о степени растворимости данного соединения в определенных условиях. [13]
Следует обратить внимание на то, что методом осаждения не удается получить достаточно глубокого умягчения воды. Объясняется это, во-первых, тем, что СаОО3 и Mg ( OH) 2 обладают все же некоторой растворимостью в воде и, во-вторых, достижением предела растворимости данного соединения еще не заканчивается процесс выделения его в осадок. [14]
 |
Схема реагентного умягчения воды. [15] |
Страницы: 1 2