Растворимость - комплексное соединение
Cтраница 1
Растворимость комплексных соединений зависит от типа аниона во внешней сфере. [1]
Растворимость комплексного соединения отвечает положению равновесия между фазами, которое далеко не всегда устанавливается быстро. Вместе с тем для описания кинетики осаждения необходимо знание пересыщения в данный момент времени. Следовательно, при установлении зависимости скорости кристаллизации от пересыщения должны учитываться значения констант нестойкости комплексных ионов. Эти константы представляют интерес и с другой точки зрения. Они помогают учесть влияние концентрации одноименных ионов на растворимость и, следовательно, на степень пересыщения. [2]
Растворимость комплексных соединений связана с некоторыми факторами. [3]
Растворимость комплексных соединений зависит и от состава внутренней сферы. [4]
Если произведение растворимости комплексного соединения превышает произведение растворимости малорастворимого вещества, то эта соль может выпасть в осадок. Такой случай наблюдается для иодида ртути HgJ2 при образовании комплекса KstHgJJ - конец титрования наступает раньше достижения точки эквивалентности. [5]
Сольва-тационные процессы здесь определяют растворимость комплексных соединений в смешанных растворителях. [6]
Не исключена также возможность по нижения растворимости комплексных соединений палладия при изменении концентрационных соотношений и рН в прикатодном слое, а также изменения сольватационных равновесий в двойном слое. [7]
При очень высокой концентрации сульфат - и хлорид-ионов уменьшается растворимость комплексного соединения в воде; в таких случаях наблюдается выделение красного осадка. [8]
Модификации лигандного окружения, приводящие к изменению электронных эффектов или к повышению растворимости комплексного соединения в том или ином растворителе, в целом существенно не меняют селективность и выход карбонильных соединений при окислении спиртов. К сожалению, в промышленности гомогенное каталитическое окисление спиртов пока не находит широкого применения, хотя в тонком органическом синтезе оно применяется. [9]
Анализ данных по свойствам комплексных соединений гидразина показывает, что, как правило, с увеличением числа координационно связанных молекул гидразина растворимость комплексных соединений уменьшается. Например, при увеличении отношения N2H4: Ni свыше двух в водном растворе выпадает осадок красного цвета. [10]
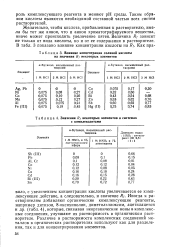 |
Влияние концентрации соляной кислоты на значения R / некоторых элементов.| Значения Rf некоторых элементов в системах с комплексантами. [11] |
Иногда к растворителям добавляют органические комплексующие реагенты, например дитизон, 8-оксихинолин, диметилглиоксим, ацетилацетон и др. ( табл. 4), которые, связывая неорганические ионы в комплексные соединения, улучшают их растворимость в органическом растворителе. Различие в растворимости комплексных соединений металлов в органических растворителях используют как для разделения, так и для концентрирования элементов. [12]
При определении понятия двухкомпонент-ной системы приходится сталкиваться с затруднениями, поскольку комплексные соединения, в зависимости от их стойкости, можно рассматривать как двухкомпонентные пли трехкомпонентные системы. Поэтому данные по растворимости комплексных соединений и двойных солей в справочник не включены. Исключение составляют кислые соли, некоторые основные соли, ферро - и феррициаеиды. [13]
Растворимость уменьшается в ряду от иттербия к церию, а устойчивость растворимых комплексных соединений увеличивается в обратном порядке. Характер образующихся комплексных соединений металлов определяется также молекулярным составом фульвокислот; в частности, растворимость комплексных соединений РЗЭ уменьшается с увеличением среднего молекулярного веса фульвокислот. [14]
В винной кислоте сочетается два характерных свойства, определяющих природу комплексных соединений; первое - связано с содержанием двух карбоксильных групп, способствующих образованию химической связи с металло-катионами по месту протона, и второе - с содержанием двух спиртовых групп, способствующих образованию химической связи с молекулами воды как растворителя. Совершенно правильное объяснение по этому поводу дает Яцимир-ский 17j, указывая, что в тех случаях, когда между комплексными ионами и молекулами воды возникает химическая связь типа водородной, растворимость комплексного соединения больше, чем у аналогичных соединений, неспособных к химическому взаимодействию с молекулами растворителя. [15]
Страницы: 1 2