Растворимость - малорастворимая соль
Cтраница 2
Если посторонняя соль увеличивает растворимость малорастворимой соли, то это называют солевым эффектом. Добавка посторонней соли, увеличивая ионную силу раствора, влияет на коэффициенты активности ионов, образующих данную малорастворимую соль. Растворимость соли может увеличиться вследствие комплексооб-разования. [16]
Потенциометрия позволяет определить произведение растворимости малорастворимой соли. [17]
Прибавление кислоты для увеличения растворимости малорастворимой соли имеет очень большое применение в аналитической химии. Например, в нейтральном растворе ионы серебра осаждают как хлорид -, так и фосфат-ионы. В кислых же растворах осаждается только хлорид серебра. [18]
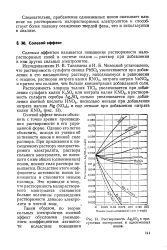 |
Растворимость Ag2SO4 в присутствии посторонних и одноименных ионов. [19] |
Солевым эффектом называется повышение растворимости малорастворимых солей в системе осадок - раствор при добавлении к ним других сильных электролитов. [20]
Таким образом, вопрос о растворимости малорастворимых солей в растворах электролитов вышел далеко за пределы аналитической химии. [21]
Измерение электропроводности позволяет также определить растворимость малорастворимой соли. [22]
КОН, КС1) изменяет растворимость малорастворимых солей. Однако этот приближенный расчет показывает, что концентрация ионов Hg2 в растворе каломели примерно в 106 раз больше, чем в растворе закиси ртути. Столь большое различие позволяет утверждать, что ртутный электрод в растворе закиси ртути должен быть отрицательнее, чем такой же электрод в растворе каломели. Этот вывод, конечно, совпадает с наблюдаемыми фактами. [23]
Измерение электропроводности позволяет также определить растворимость малорастворимой соли. [24]
КОН, КС1) изменяет растворимость малорастворимых солей. Однако этот приближенный расчет показывает, что концентрация ионов Hg2 в растворе каломели примерно в 10е раз больше, чем в растворе закиси ртути. Столь большое различие позволяет утверждать, что ртутный электрод в растворе закиси ртути должен быть отрицательнее, чем такой же электрод в растворе каломели. Этот вывод, конечно, совпадает с наблюдаемыми фактами. [25]
Измерение электропроводности позволяет также определить растворимость малорастворимой соли. [26]
При повышении ионной силы раствора растворимость малорастворимых солей увеличивается. Как влияет ионная сила на растворимость хорошо растворимых солей. [27]
При повышении ионной силы раствора растворимость малорастворимых солей увеличивается. Как влияет ионная соль на растворимость хорошо растворимых солей. [28]
Следует отметить, что сравнивать растворимость малорастворимых солей по величине их произведений растворимости можно лишь в тех случаях, когда их состав соответствует химической формуле одного и того же типа. [29]
При повышении ионной силы раствора растворимость малорастворимых солей увеличивается. Как влияет ионная соль на растворимость хорошо растворимых солей. [30]
Страницы: 1 2 3 4