Растворимость - сульфат - кальций
Cтраница 3
В этих комплексах растворимость сульфата кальция возрастает, в результате чего эффект фиксации значения рНЗ 5 существенно снижается. С другой стороны, при нейтрализации щелока гидроксидом кальция в результате связывания присутствующей серной кислоты происходит дополнительное образование подлежащего удалению сульфата кальция. [31]
Влияние давления на растворимость сульфата кальция сравнительно невелико. При низкой и высокой минерализациях ( менее 80 и более 200 г / л) влияние давления совершенно незначительно. [32]
Этанол значительно снижает растворимость сульфата кальция, но полного выделения кальция из раствора не достигается. [33]
Воспользуемся значениями произведений растворимости сульфата кальция и карбоната кальция, чтобы решить вопрос, выпадут ли в осадок эти соли при смешивании равных объемов миллимолярных растворов: в первом случае сульфата натрия и хлорида кальция, во втором - карбоната натрия и хлорида кальция. [34]
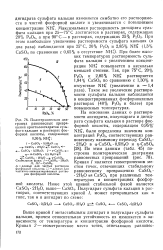 |
Политермическая диаграмма равновесных превращений кристаллогидратов сульфата кальция в растворах фосфорной кислоты, содержащих 0 95 % NHJ. [35] |
Такое же увеличение растворимости сульфата кальция наблюдается в концентрированных фосфорнокислых растворах ( 40 % Р2О5 и более) при повышенных температурах. [36]
Рассмотрим, например, растворимость сульфата кальция. При комнатной температуре в равновесии с водным раствором находится осадок кристаллогидрата CaSO4 - 2H2O, растворимость которого увеличивается с повышением температуры. Однако при 60 С этот кристаллогидрат теряет часть своей кристаллизационной воды, превращаясь в кристаллогидрат состава CaSCWzHzO, растворимость которого с повышением температуры уменьшается, поэтому кривая растворимости сульфата кальция имеет максимум при 60 С. [37]
Рассмотрим, например, растворимость сульфата кальция. При обычных температурах в равновесии с водным раствором находится осадок кристаллогидрата CaSO4 - 2H2O, растворимость которого возрастает с повышением температуры. [38]
На рис. 36 показана растворимость сульфата кальция в рассоле, которая в условиях электролиза составляет примерно 5 г / л CaSO4, что отвечает концентрации 1 5 г / л ионов кальция и 3 5 г / л сульфат-ионов. Обычно при работе на неочищенном рассоле предпочитают несколько более высокую концентрацию сульфат-ионов ( 4 - 5 г / л), соответствующую содержанию в рассоле 1 0 - 1 2 г / л кальция. [39]
Имеется мало данных о растворимости сульфата кальция в смешанных растворах хлорида натрия и сульфата натрия. [40]
Рассмотрим, например, растворимость сульфата кальция. При комнатной температуре в равновесии с водным раствором находится осадок кристаллогидрата CaSO4 - 2H2O, растворимость которого увеличивается с повышением температуры. [41]
Полученные данные по увеличению растворимости сульфата кальция в частично аммонизированных растворах фосфорной кислоты обосновывают возможность улучшения условий кристаллизации дигидрата сульфата кальция и осаждения его в виде более крупных хорошо фильтрующих кристаллов при сернокислотной экстракции природных фосфатов. При этом, в первую очередь, можно рассчитывать на укрупнение кристаллов гипса, выделяющихся из сравнительно разбавленных растворов, содержащих 30 % Р2О5, так как именно в этих растворах наблюдается максимальное влияние NH4 на растворимость сульфата кальция. [42]
В присутствии небольшого избытка сульфат-ионов растворимость сульфата кальция уменьшается, о отношение последнего к водородному иону такое же, как и карбоната кальция. HSCV, действует - растворяющим образом на CaSOi. [43]
В присутствии небольшого избытка сульфат-ионов растворимость сульфата кальция уменьшается, о отношение последнего к водородному иону такое же, как и карбоната кальция. Такое действие может оказать сама серная кислота или другая сильная кислота. [44]
При этой температуре резко снижается растворимость сульфата кальция, и он выделяется в осадок. [45]
Страницы: 1 2 3 4