Растворимость - сульфат - натрий
Cтраница 2
С показали, что растворимость сульфата натрия в щелочных растворах сильно меняется в зависимости от содержания в них карбоната натрия. Сульфат и карбонат натрия образуют двойную соль 2Ш25О4 - Ма2СОз, которая дает твердые растворы с сульфатом и с карбонатом натрия. Беркеит в этой системе занимает значительную часть общего объема кристаллизации. Растворимость сульфата натрия при его совместной кристаллизации с беркеитом высока и в 25 - 26 % - ном растворе NaOH при 50 С составляет около 12 г / л; при совместной же кристаллизации беркеита с содой растворимость сульфата натрия сильно понижается. [16]
Как показывает диаграмма, растворимость сульфата натрия в кислоте сильно возрастает, начиная от 4 % ( вес. При повышении температуры до 270 растворимость увеличивается до 67 %; при дальнейшем повышении температуры растворимость возрастает медленнее. [17]
Примером может служить кривая растворимости сульфата натрия. Растворимость кристаллогидрата сульфата натрия Na2SO4 - 10H2O возрастает с повышением температуры от 0 до 32 28 С. Выше 32 28 С эта соль теряет воду. Безводный сернокислый натрий при повышении температуры снижает свою растворимость. [18]
Растворимость СаСЬ оказалась значительно выше растворимости сульфата натрия. Ввиду гидролиза, наряду с СаСЬ в водяном паре обнаружено также некоторое количество хлористого водорода. [19]
По данным работы [25], растворимость сульфата натрия в воде при 400 С и 200 кГ / см2 составляет около 10 - 6 вес. [20]
Стырикович опубликовал данные о характере растворимости сульфата натрия в перегретом паре. Немногие данные, сообщенные Мори и Хессельгессером, сильно отличаются друг от друга. По данным Стыриковича, растворимость сульфата натрия всегда очень низка, так же как и растворимость сульфата кальция. [21]
Этот способ основан на понижении растворимости сульфата натрия в присутствии хлорида натрия. Получаемый в результате переработки сульфат натрия содержит до 96 % основного вещества, имеет вид серых гранул и может быть использован в производстве сульфида натрия. Смешанная соль, полученная при сушке маточного раствора ( после отделения кристаллов сульфата натрия) в аппарате КС, содержит ж 70 % Nad, до 30 % Na2SO4 и других серосодержащих солей и не находит применения. [22]
На рис. 64 приводятся политермы растворимости сульфатов натрия, калия, лития, двойного сульфата калия и лития и карбоната натрия в присутствии паровой фазы. Отчетливое изменение хода этих кривых, показывающее изменение знака температурного коэффициента растворимости от положительного к отрицательному, судя по всем данным, не связано с полиморфными превращениями солей в твердой фазе. [23]
На рис. 16 приведена диаграмма растворимости сульфата натрия в воде. [24]
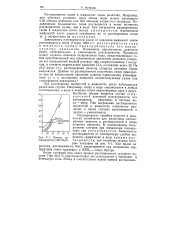 |
Кривые растворимости ( г / 100 г НаО. [25] |
Более сложный вид имеет кривая растворимости сульфата натрия. При 32 4 С кристаллогидрат его распадается и переходит в безводную соль. [26]
Изогидрическая кристаллизация мирабилита основана на понижении растворимости сульфата натрия при охлаждении растворов. [27]
Экспериментальные методики, использованные для определения растворимости сульфатов натрия и калия, описаны в главе II. Растворимость сульфата лития при высоких температурах была определена методом отбора проб для анализа. Тот же метод был применен и для определения растворимости карбоната натрия при высоких температурах. Хотя их данные недостаточно хорошо согласуются между собой, но все они сходятся с нашими определениями в том, что концентрации карбоната натрия в растворе при достаточном приближении к критической температуре воды очень невелики и температурный коэффициент растворимости безводного карбоната натрия отрицателен. [28]
Растворение мирабилита возможно по причине обратной температурной зависимости растворимости сульфата натрия. Получаемая в процессе выпаривания суспензия разделяется в фильтрующих машинах; маточный раствор с температурой 100 С подают в растворитель. [29]
Поскольку кристаллизация у теплопередающих поверхностей связана с понижением растворимости сульфата натрия, одним из средств ее предотвращения служит усиленная циркуляция раствора. Использование затравочных кристаллов, с одной стороны, способствует снятию пересыщения, а с другой, может стать причиной появления вторичных зародышей. Поэтому введению затравки должно предшествовать нахождение оптимального ее варианта как по массе, так и по гранулометрическому составу. [30]
Страницы: 1 2 3 4