Растворимость - сульфат - натрий
Cтраница 3
Полученные значения коэффициентов при данном виде полинома позволяют вычислить растворимость сульфата натрия в растворах хлорида натрия с относительным среднеквадратичным отклонением не более 3 %, а в большинстве случаев 1 %, что не выходит за рамки точности экспериментального определения растворимости, особенно в области низких температур. [31]
 |
Кристаллизация арсо-нида индия из расплавов системы In As-Cd. [32] |
Изотермы NaCl - Na2S04 - H2O [96] отражают эффект понижения растворимости сульфата натрия в присутствии поваренной соли или ее высаливающее действие на сульфат натрия. На изотерме же 50 С эвтоника совместной кристаллизации NaCl и Na2S04 находится при содержании 33 69 г NaCl и 7 33 г Na2S04 на 100 г воды. При этом сульфат выделяется в безводном состоянии. [33]
Следовательно, растворимость сульфата калия в паре должна быть близка к растворимости сульфата натрия. [34]
Соль отфильтрованная на этой центрифуге, поступав в бак поз 227г, где раосол, циркулируя через спиральный теплообменник поз, 230, охлаждается до температуры 1втЙО 0, при которой растворимость сульфата натрия максимальна, За счет повышения растворимости сульфата натрия в холодном рассоле происходит его нападение до 30 60 г / л Приготовленный сульфатный рассол наоо. [35]
Соль отфильтрованная на этой центрифуге, поступав в бак поз 227г, где раосол, циркулируя через спиральный теплообменник поз, 230, охлаждается до температуры 1втЙО 0, при которой растворимость сульфата натрия максимальна, За счет повышения растворимости сульфата натрия в холодном рассоле происходит его нападение до 30 60 г / л Приготовленный сульфатный рассол наоо. [36]
Растворимость сульфата натрия при 80 С и 20 С равна 41 9 г и 21 0 г соответственно. [37]
На одном из заводов штата Техас природный сульфат натрия получают по следующей технологической схеме. Для снижения растворимости сульфата натрия в рассоле ( содержите 7 - 11 % Na2SO4 и некоторое количество NaCl и MgSO4) его насыщают поваренной солью. Обогащенный солью раствор охлаждается жидким аммиаком до температуры минус 7 - минус 9 С и поступает в кристаллизатор. Выделившиеся кристаллы глауберовой соли ( Na2SO4 - 10H2O) направляют в выпарной аппарат с погружным горением, где они плавятся, а большая часть воды испаряется. [38]
В интервале 32 4 С t 350 С сульфатсодержащей твердой фазой является одна из безводных форм сульфата натрия: тенардит ( до 240 С), p - Na2S04 ( монокл. Сравнение данных по растворимости сульфата натрия в воде и водных растворах хлорида натрия показывает, что при любых концентрациях хлор-иона растворимость сульфата натрия уменьшается. Это используют иногда для практических целей. [39]
Кристаллы всех указанных соединений бесцветны, но безводный сульфат натрия образует кристаллы, относящиеся к ромбической сингонии, семиводный - к тетрагональной или ромбической и десятиводный - к моноклинной. Кривая, отражающая зависимость растворимости сульфата натрия от температуры, проходит через максимум, приходящийся примерно на 32 С. При повышении температуры от 0 до 32 С растворимость растет. Дальнейшее повышение температуры приводит к ее уменьшению. [40]
 |
Давление насыщенных паров Р ( мм рт. ст. для различных кристаллогидратов сульфата меди в зависимости от температуры ( а и числа молекул кристаллогидратной воды п при t 50 С ( б. [41] |
Изображенная на рис. 27 диаграмма растворимости системы Na2SO4 - H2O показывает, что сульфат натрия может кристаллизоваться в безводной форме, в виде десятиводного кристаллогидрата, а также как метастабильная семиводная соль. Из диаграммы следует, что растворимость сульфата натрия понижается с повышением температуры от 32 4 до 120 С. При температуре ниже 32 4 С соль кристаллизуется в виде десятиводного кристаллогидрата моноклинной сингонии, при температурах от 32 4 до 233 С - в ромбической форме и при температурах свыше 233 С - в моноклинной форме. [42]
Система Na, NH3 SO, H20 характеризуется образованием двух твердых фаз - тенардита и мирабилита. В сочетании со слабым влиянием температуры на растворимость сульфата натрия в водно-аммиачных растворах использование аммиака для выделения сульфата натрия при условии создания герметически изолированной системы может представлять интерес при переработке сырья низкого качества, например содержащего большое количество нерастворимого в воде остатка. [43]
Ошибочность этого мнения заключается в недооценке величины растворимости сульфата натрия в перегретом паре, которая хотя и незначительна, но с ростом давления пара увеличивается. Незначительное содержание в отложениях турбин высокого давления едкого натра объясняется не малой концентрацией его в паре, а значительным содержанием в паре высокого давления кремниевой кислоты, с которой щелочь вступает во взаимодействие. [44]
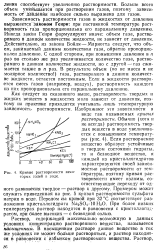 |
Кривые растворимости некоторых солей в воде. [45] |
Страницы: 1 2 3 4