Растворимость - неполярный газ
Cтраница 1
Растворимость неполярных газов Н2, N2, O2 ( jA 0) в воде очень мала, так как между ними и полярными молекулами воды могут возникать лишь дисперсионные силы взаимодействия, что приводит к малой энергии связи. Молекулы двуокиси углерода СО2 ( [ 0) обладают полярными связями и при взаимодействии с молекулами воды могут приобрести значительный индуцированный диполь-ный момент - растворимость СО а в воде значительная. [1]
Растворимость неполярных газов в растворителе частично обусловливается энтальпией растворения, которая в свою очередь в грубом приближении пропорциональна электрической поляризуемости молекул растворенного вещества. [2]
Растворимость неполярных газов в воде по сравнению с другими растворителями минимальна. [3]
Учитывая, что растворимость неполярных газов в воде мала даже при высоких давлениях, для расчета растворимости газов широко применяется теория разбавленных растворов ( уравнение Кричевского - Ильинской) III. В / 1 / отмечается, что при небольших давлениях для расчета влагосодержания можно применять уравнение состояние со вторым вириальным коэффициентом, там же упоминается об использовании для этой цели уравнения Редхиха-Квонга, соответствующим образом модифицированного Де Сантисом. [4]
Причины аномального поведения растворимости неполярных газов в воде занимают исследователей уже более полувека. Упрощенное объяснение указанных особенностей с качественной точки зрения давно уже было дано на основании элементарных представлений о строении жидкой воды и кристаллогидратов ( клатратных гидратов) газов. Один из вариантов такого объяснения приводится ниже. [5]
Непротиворечивое объяснение существования минимума растворимости неполярных газов в воде и изменения Tmin под влиянием различных факторов является серьезным критерием проверки справедливости исходных модельных приближений. В этой связи важно подчеркнуть, что при исследовании растворимости необходимо обязательно рассматривать ряд газов, ибо в противном случае можно легко прийти к неправильным заключениям. [6]
Если исключить системы, в которых в больших количествах присутствуют диоксид углерода или сероводород, то растворимость неполярных газов в воде подчиняется закону Генри при температурах до 250 С и давлениях до 100 МПа. В этих пределах растворимости газов в воде можно рассчитывать по закону Генри, используя приведенные в гл. [7]
Хотя в обзорной литературе высказывается мнение, что величина дипольного момента растворителя не оказывает существенного влияния на растворимость неполярных газов, выведенное Семенченко правило говорит о противоположном - растворимость данного вещества проходит через максимум в ряду растворителей, расположенных по возрастающему значению межмолекулярного взаимодействия в них. [8]
Влияние структурного состояния воды на гидратацию ионов ярко отражается в таких явлениях, как изменение гидратации ионов с температурой [77, 78], давлением [74] и под влиянием добавок неэлектролитов, солевые эффекты растворимости неполярных газов, наличие у ряда ионов отрицательной гидратации и зависимость границы между положительной и отрицательной гидратацией от температуры [75], давления, концентрации [76], добавок неэлектролита и изотопного состава воды. [9]
Сопоставление растворимости различных газов в одинаковых условиях не позволяет пока установить какой-нибудь простой общей закономерности. Если сравнивать растворимость различных неполярных газов в неполярных растворителях, то газы, легче сжижаемые в чистом состоянии, например обладающие более высокой критической температурой, обычно являются более растворимыми. Можно заметить также, что газы, обладающие полярными молекулами, растворяются, при прочих равных условиях, лучше в полярных растворителях, чем в неполярных. В табл. 31 приведены данные о растворимости некоторых газов в различных растворителях. [10]
Сопоставление растворимости различных газов в одинаковых условиях не позволяет пока установить какой-нибудь простой общей закономерности. Если сравнивать растворимость различных неполярных газов в неполярных растворителях, то газы, легче сжижаемые в чистом состоянии, например обладающие более высокой критической температурой, обычно являются более растворимыми. Можно заметить также, что газы, обладающие полярными молекулами, растворяются, при прочих равных условиях, лучше в полярных растворителях, чем в неполярных. В табл. 31 приведены данные о растворимости некоторых газов в различных растворителях. [11]
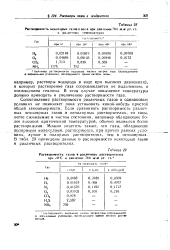 |
Растворимость некоторых газов в во е при давлении 760 мм рт. ст. [12] |
Сопоставление растворимости различных газов в одинаковых условиях не позволяет пока установить какой-нибудь простой общей закономерности. Если сравнивать растворимость различных неполярных газов в неполярных растворителях, то газы, легче сжижаемые в чистом состоянии, например обладающие более высокой критической температурой, обычно являются более растворимыми. Можно заметить также, что газы, обладающие полярными молекулами, растворяются, при прочих равных условиях, лучше в полярных растворителях, чем в неполярных. В табл. 29 приведены данные о растворимости некоторых газов в различных растворителях. [13]
 |
Растворимость некоторых газов в воде при различных температурах я давлении 760 мм рт. ст. [14] |
Сопоставление растворимости различных газов в одинаковых условиях не позволяет пока установить какой-нибудь простой общей закономерности. Если сравнивать растворимость различных неполярных газов в неполярных растворителях, то газы, легче сжижаемые в чистом состоянии, например обладающие более высокой критической температурой, обычно являются более растворимыми. Можно заметить также, что газы, обладающие полярными молекулами, растворяются при прочих равных условиях лучше в полярных растворителях, чем в неполярных. В табл. 55 приведены данные о растворимости некоторых газов в различных растворителях. [15]
Страницы: 1 2