Кривая растворимость
Cтраница 4
Рассмотрим кривые растворимости простых солей. [46]
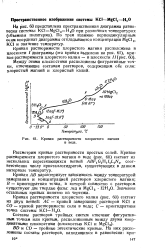 |
Кривая растворимости хлористого магния в воде. [47] |
Рассмотрим кривые растворимости простых солей. Кривая растворимости хлористого магния в воде ( рис. 60) состоит из нескольких пересекающихся ветвей BF1C1H1 / 1L1AT1, соответственно числу кристаллогидратов, существующих в данном интервале температур. [48]
 |
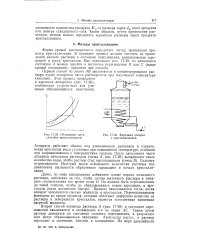
Кривая растворимости медного купороса. [49] |
По кривой растворимости можно графически определить растворимость вещества при различных температурах, производить расчеты, необходимые для осуществления процесса перекристаллизации, с помощью которого проводят очистку твердых веществ. [50]
 |
Объяснение двух способов кристаллизации.| Варочный аппарат с кристаллизацией. [51] |
Форма кривой растворимости определяет метод проведения процесса кристаллизации. В принципе процесс должен состоять из приведения данного раствора в состояние пересыщения, возникновения зародышей и роста кристаллов. Как показывает рис. 17 - 29, из начального состояния А можно перейти в состояние пересыщения В или С ( выше кривой насыщения), применяя два способа. [52]
Перегиб кривой растворимости и возрастание коэффициента а некоторых газов происходят в связи с увеличением объема жидкости и влиянием этого процесса на концентрацию газа в ней. [53]
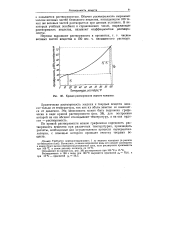 |
Кривая растворимости медного купороса. [54] |
По кривой растворимости можно графически определить растворимость вещества при различных температурах, производить расчеты, необходимые для осуществления процесса перекристаллизации, с помощью которого проводят очистку твердых веществ. [55]
По кривой растворимости для выбранной системы, найденной экспериментально, получено, что коэффициент а остается практически постоянным на всем интервале изменения давления. [56]
Ветви кривой растворимости, сходящиеся в точке М ( 167 5 С), прерываются при температуре 99 С, которой соответствует начало испарения. Такой характер имеют диаграммы для систем, у которых давление паров равновесных жидких фаз больше давления паров чистых компонентов. Когда давление паров в области существования двух жидких фаз имеет значение, промежуточное между величинами давлений паров чистых компонентов, для системы пар - жидкость наблюдается равновесие иного типа, но кривая растворимости и в этом случае прерывается. [57]
AF кривой растворимости и поэтому вес второй жидкой фазы, ей равновесной, очевидно, равен нулю. Начальная система недогрета до точки кипения и для начала ее перегонки необходимо поднять температуру t0 системы до значения, отвечающего фигуративной точке L, лежащей на изобарной кривой кипения АС жидкой фазы. В точке L жидкость приходит в насыщенное состояние и состав первого пузырька равновесного ей пара изобразится абсциссой точки V, представляющей точку пересечения изотермы начала кипения системы с изобарной, кривой конденсации СЕ. [58]
 |
Криогидратные точки некоторых солей. [59] |
Направление кривой растворимости можно предсказать с помощью закона Вант-Гоффа и принципа Ле Шателье, но при этом необходимо учитывать особенности процесса растворения электролитов в воде. Увеличение растворимости при повышении температуры наступает в тех случаях, когда в процессе растворения соли поглощается тепло. Если же при растворении соли выделяется тепло, ее растворимость с повышением температуры уменьшается. Изменение температуры не оказывает влияния на растворение соли, если оно не сопровождается заметным тепловым эффектом. Наличие экстремальной точки на кривой растворимости показывает, что знак теплового эффекта при этой температуре меняется. [60]
Страницы: 1 2 3 4 5