Нивелирующий растворитель
Cтраница 1
Нивелирующий растворитель - растворитель, в котором кислоты и основания различной природы не изменяют соотношения в своей силе. [1]
Нивелирующие растворители - это растворители, в которых сохраняется соотношение в силе кислот или оснований, характерное для водных растворов этих электролитов. [2]
Нивелирующими растворителями для кислот будут вещества с большим сродством к протону - аммиак и его органические производные, гидразин, вода. [3]
Наиболее эффективные нивелирующие растворители для кислот характеризуются сильноосновными свойствами, например, протофильные растворители, имеющие относительно сильные протонно-акцепторные свойства. [4]
Наиболее эффективными нивелирующими растворителями в отношении оснований являются протогенные растворители, которые обладают ярко выраженными протонодонорными свойствами. [5]
Следовательно, гидразин является нивелирующим растворителем, принадлежащим к тому же классу, что и вода, спирты и аммиак. Расчеты классической степени диссоциации показывают, что гидразин принадлежит к лучшим ионизирующим растворителям и что при сильном разбавлении ( V - 375 л) все исследованные электролиты диссоциированы в одинаковой степени и практически нацело. В безводном гидразине различие в силе отдельных электролитов не наблюдается. Поведение различных электролитов, как, например, солей серебра и лития, а также N-замещенных солей аммония, в гидразине резко отличается от их поведения в таких дифференцирующих растворителях, как ацетонитрил, нитрометан и ацетон. [6]
Гидразин как и вода, является нивелирующим растворителем. [7]
 |
Нивелирующее действие воды как растворителя на силу сильных кислот. [8] |
Аналогичным образом протогенный растворитель, например СНзСООН, является нивелирующим растворителем в отношении оснований, реагируя с большинством общеизвестных сильных оснований и уравнивая их по силе со своим ацетат-ионом, являющимся сильным основанием. [9]
Благодаря сильным кислотным свойствам фтористый водород действует на основания как нивелирующий растворитель. [10]
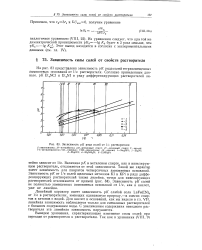 |
Зависимость р / С ряда солей от 1 / е растворителя. [11] |
Величина р / С в метиловом спирте, как в нивелирующем растворителе, отклоняется от этой зависимости. Такой же характер имеет зависимость для пикратов четвертичных аммониевых оснований. Зависимость рК солей не полностью замещенных аммониевых оснований от 1 / е, как и кислот, уже не линейна. [12]
Вальден нашел, что в воде и в спиртах ( нивелирующих растворителях) различные по своей природе соли являются сильными электролитами, а в нитробензоле, нитрометане и пиридине ( дифференцирующих растворителях) эти соли ведут себя неодинаково. [13]
Даже вода, которая, по мнению многих исследователей, является нивелирующим растворителем, оказывает дифференцирующее действие в отношении кислот, обладающих малым отношением второй константы диссоциации к первой ( Кплп. [14]
Исследования Вальдена показали, что в воде и в спиртах ( нивелирующих растворителях) различные по своей природе соли являются сильными электролитами, а в нитробензоле, нитрометане и пиридине ( дифференцирующих растворителях) эти соли ведут себя неодинаково. [15]
Страницы: 1 2 3 4