Нивелирующий растворитель
Cтраница 3
Спирты в небольшой степени дифференцируют силу кислот различной природы, хотя по отношению к солям они являются типичными нивелирующими растворителями. [31]
К нивелирующим относят растворители, в среде которых сила кислот, оснований и солей уравнивается; или, строго говоря, нивелирующими растворителями являются такие, в среде которых соотношения в силе электролитов ( т.е. / Снлп, п: ХНАП, i и KutAn, п: / CictAn, i), характерные для водных растворов электролитов, сохраняются ( см. книга 2, гл. [32]
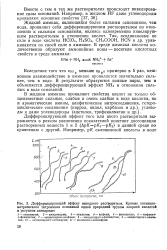 |
Дифференцирующий эффект неводного растворителя. Кривые потенцио-метрического титрования оснований одной природной группы хлорной кислотой в уксусном ангидриде. [33] |
Жидкий аммиак, являющийся более сильным основанием, чем вода, проявляет себя дифференцирующим растворителем по отношению к сильным основаниям, являясь одновременно нивелирующим растворителем в отношении кислот. Так, неодинаковые по силе в воде кислоты НСЮ4, H2SO4, CH3COOH, HCN и др. уравниваются по своей силе в аммиаке. [34]
Когда необходима высокая кислотность ( или основность), как, например, при использовании кислоты ( основания) в качестве катализатора, следует выбирать мало нивелирующий растворитель. [35]
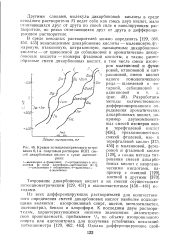 |
Кривые потенциометрического титрования 0 1 н. спиртовым раствором КОН смесей дикарбоновых кислот в среде ацетонит-рила. [36] |
Другими словами, молекула дикарбоновой кислоты в среде неводного растворителя М ведет себя как смесь двух кислот, мало отличающихся друг от друга по своей силе в нивелирующем растворителе, но резко отличающихся друг от друга в дифференцирующем растворителе. [37]
 |
Константы ионизации некоторых кислот в СНзСООН при 20 С. [38] |
Растворители, в которых сглаживаются различия в силе кислот ( или оснований), называются нивелирующими. Нивелирующими растворителями для кислот будут вещества с большим сродством к протону - жидкий аммиак и его органические производные, гидразин, вода. [39]
По характеру влияния растворителей на относительную силу кислот, оснований и солей и по их способности изменять соотношения в силе электролитов все растворители делятся на две группы: дифференцирующие и нивелирующие. К нивелирующим растворителям относятся такие растворители, в среде которых силы разных кислот ( оснований, солей) уравниваются или, строго говоря, растворители, в которых соотношения в силе электролитов, характерные для их водных растворов, сохраняются. В этих растворителях соотношения в силе электролитов иные, чем в воде. Не следует смешивать классификацию растворителей на амфипротные, кислые и основные с классификацией на нивелирующие и дифференцирующие, так как эти классификации основаны на принципиально различных признаках. [40]
Исследуя диссоциацию солей в разных растворителях, Вальден установил, что в ряде растворителей ( в том числе и в различающихся значениями диэлектрической проницаемости) многие соли одинаково хорошо диссоциируют. Типичным нивелирующим растворителем в отношении солей является вода. Как известно, почти все соли в воде независимо от их природы-сильные электролиты. Между тем в ряде растворителей с одинаковой диэлектрической проницаемостью степени диссоциации одних и тех же солей сильно различаются. Например, в метаноле ( е 31 5), ацетонитриле ( е 37 5), нитробензоле ( е 34 89) и нитрометане ( е 38 57) коэффициенты электропроводности АД0 а одних и тех же солей резко различаются. [41]
По влиянию на кислотно-основные свойства растворенного вещества растворители подразделяют на нивелирующие и дифференцирующие. В нивелирующих растворителях сила некоторых кислот, оснований и других электролитов становится примерно одинаковой, а в дифференцирующих - разной. Уравнивание силы электролитов в нивелирующих растворителях имеет не всеобщий характер: нельзя считать, например, что в нивелирующих растворителях все кислоты становятся сильными или все слабыми. Многие минеральные кислоты - хлорная, хлороводородная, бромоводородная, азотная и др. в водном растворе Диссоциированы нацело с образованием НзО как продукта взаимодействия кислоты с водой. Вода оказывает нивелирующее действие на силу сильных кислот. [42]
В нивелирующих растворителях соли диссоциированы примерно одинаково и почти полностью, в дифференцирующих - степень диссоциации электролитов резко различна. Типичным нивелирующим растворителем является, например, вода, типичным дифференцирующим - ацетон. [43]
Растворители, в которых сглаживаются различия в силе кислот ( или оснований), называются нивелирующими. Для кислот нивелирующими растворителями являются вещества с большим сродством к протону - жидкий аммиак и его органические производные, а также гидразин, вода. [44]
Растворители, в которых сила разных кислот ( оснований, солей) уравнивается, называются нивелирующими растворителями. Строго говоря, нивелирующими растворителями являются такие, в среде которых не проявляются значительные различия в силе электролитов и в которых кислоты ( основания, соли) различной природы не изменяют соотношения в своей силе, характерные для водных растворов. [45]
Страницы: 1 2 3 4